中文标题:CircVPRBP通过抑制RACK1蛋白O-GlcNAc修饰和稳定性来阻碍宫颈癌淋巴结转移
发表期刊:Oncogene
中科院分区:1区
影响因子:8.756
发表时间:2023年1月
合作单位:中山大学附属第一医院
运用技术:RNA免疫共沉淀(RIP)、LC-MS/MS质谱鉴定(由辉骏生物提供技术支持,点击查看服务详情)
● 研究背景
淋巴结转移是宫颈癌(CCa)患者最恶性的临床特征之一,但目前尚不清楚如何有效防止淋巴管生成和抑制宫颈癌细胞的侵袭性。circRNA比线性mRNA更稳定,可能参与许多癌症的进展。先前的研究发现,circVPRBP (hsa_circ_0065898)是在CCa中水平下调。因此本研究探索了circVPRBP在宫颈癌淋巴结转移中的生物学功能和临床意义。
● 研究结果
1. CircVPRBP在宫颈癌淋巴结转移过程中表达下调
Sanger测序首先确定了circVPRBP的剪接位点(图1A)。RT-qPCR再次确认了circVPRB在宫颈癌细胞系中的表达下调,并且在原发性肿瘤衍生细胞系HeLa、HeLa229、SiHa、C33A中的含量比转移性淋巴结衍生细胞系HT-3和MS751的更高(图1B)。同样的,circVPRBP在宫颈癌患者样本中的水平显著低于非肿瘤组织,且在淋巴结转移样本中的表达逐渐消失(图1C)。原位杂交、LYVE-1染色、Kaplan–Meier生存曲线和log-rank检验分析等实验表明, circVPRBP表达缺失在伴有淋巴结转移的原发性肿瘤中更常见(图1D),当circVPRBP水平较低时,宫颈癌瘤内和瘤周区域的淋巴管数量显著增加(图1E、F),且患者的总生存期(OS)和无病生存期(DFS)较短(图1G,H)。表明circVPRBP的缺失有助于宫颈癌淋巴结的转移,它的水平对宫颈癌患者有预后价值。
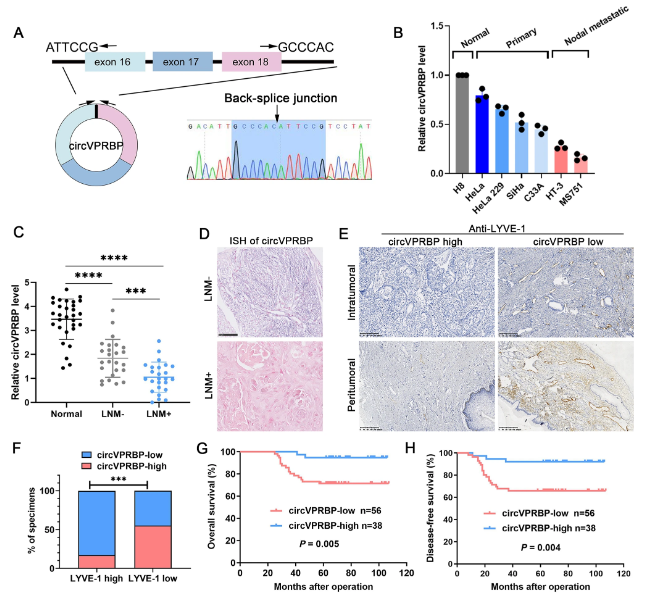
图1
2. CircVPRBP可抑制宫颈癌的体外细胞侵袭和体内淋巴结转移
研究者构建了circVPRBP过表达和沉默的宫颈癌细胞系(图2A-D),并进行了体外和体内功能实验。Transwell结果表明,circVPRBP过表达消除了宫颈癌细胞的侵袭性,沉默促进了侵袭能力(图2E,F)。在裸鼠体内淋巴结转移模型中(图2G),circVPRBP过表达显著抑制淋巴结转移,淋巴结体积较小,沉默可促进宫颈癌细胞向淋巴结转移,淋巴结体积较大(图2H,I)。角蛋白免疫组化染色也表明,circVPRBP过表达显著抑制了宫颈癌细胞的淋巴转移能力,沉默增加了淋巴结转移(图2J,K)。这些结果表明circVPRBP可以抑制体内宫颈癌的淋巴结转移。
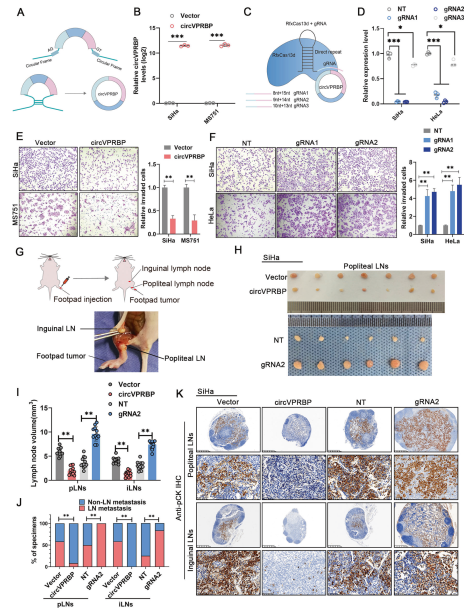
图2
3. CircVPRBP抑制体内和体外的淋巴管生成
淋巴管生成在淋巴结转移中具有重要作用,因此靶向淋巴管生成的信号通路可能是一种有效的治疗策略。为了验证circVPRB是否影响淋巴管生成,使用淋巴标记物LYVE-1的抗体进行免疫组化(IHC)分析,发现在circVPRBP过表达的小鼠体内,LYVE-1阳性血管显著减少,而在circVPRB沉默的小鼠体内显著升高(图3A,B),表明circVPRBP在体内抑制淋巴管生成。血管形成实验进一步表明,circVPRBP过表达显著抑制了人淋巴内皮细胞(HLEC)的血管形成,而circVPRB缺失显著增加了HLEC的血管形成能力(图3C,D)。
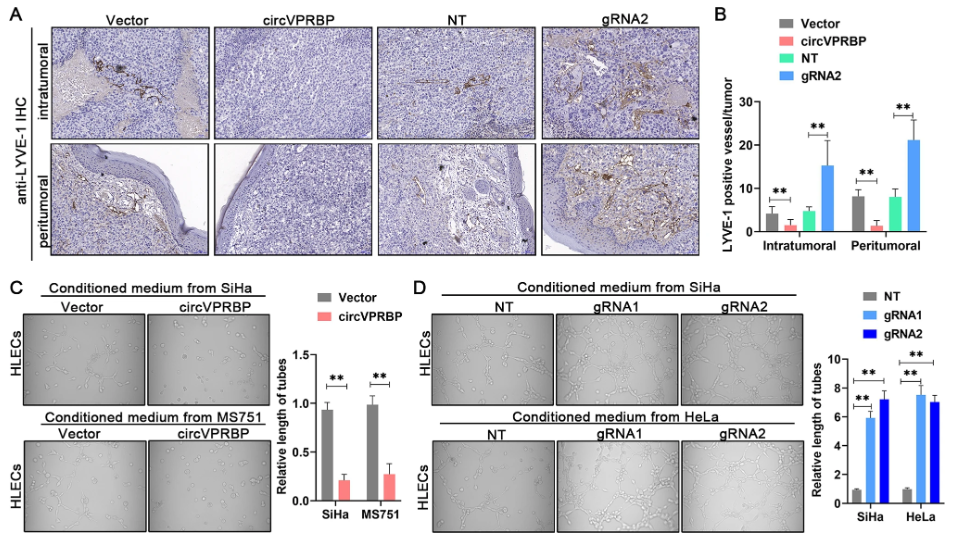
图3
致瘤性是与淋巴管生成和淋巴结转移有关的主要因素,因此研究人员分析了circVPRBP在宫颈癌中的致瘤作用。CCK-8、克隆形成和EdU增殖实验发现,circVPRBP过表达降低了宫颈癌细胞的增殖和克隆形成,而circVPRBP沉默有相反作用(图4A-H)。之后,通过构建皮下异种移植动物模型以评估circVPRBP在体内的致瘤能力,发现circVPRBP过表达降低了宫颈癌的肿瘤生长(图4I),且肿瘤重量和大小均低于对照组(图4J-O)。这些结果表明circVPRBP可以抑制癌症淋巴管的生成。
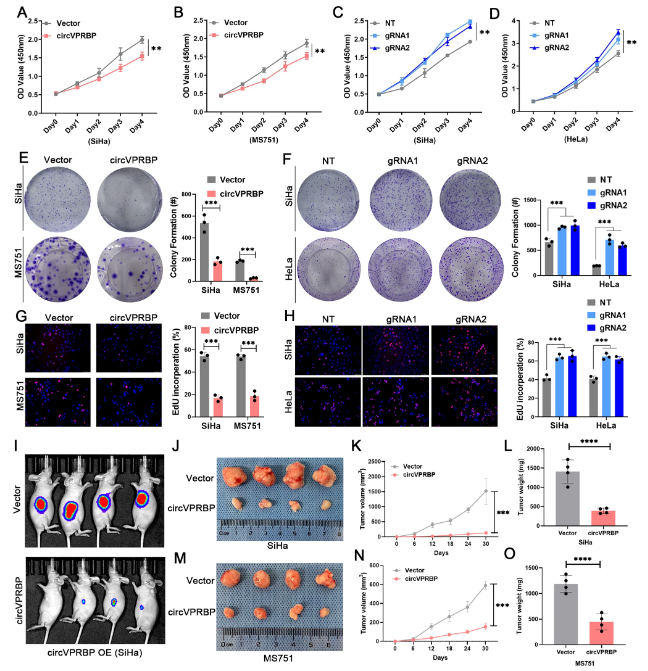
图4
4. CircVPRBP与RACK1相互作用抑制RACK1蛋白表达
接着,研究者以circVPRBP作为诱饵进行了RNA pull down和质谱(MS)检测,找到了circVPRBP的潜在结合蛋白RACK1(图5A,B),RNA免疫沉淀(RIP)实验确定了两者的内源性结合(图5C,D),荧光共定位实验也发现circVPRBP和RACK1蛋白共定位于细胞质中(图5E)。circVPRBP截短片段的RNA pull down实验进一步确定了其122-182nt片段与RACK1蛋白结合(图5F、G)。过表达circVPRBP几乎不影响RACK1的mRNA表达,但显著降低了RACK1的蛋白水平(图5F, G)。已有研究表明,宫颈癌细胞中的RACK1通过增强Galectin-1诱导的下游FAK和AKT信号通路,促进宫颈癌症淋巴管生成和淋巴结转移。本研究发现,过表达circVPRBP也抑制了pAKT、pFAK和Galectin-1的表达(图5I–K)。总之,这些结果表明circVPRBP可以结合RACK1并抑制RACK1蛋白的表达。
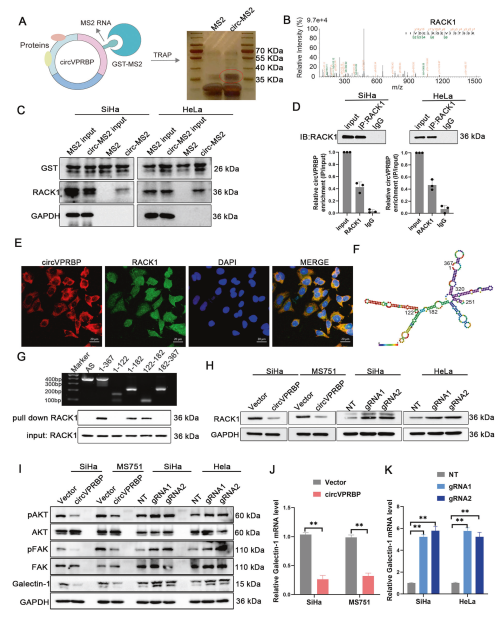
图5
5. CircVPRBP可阻碍RACK1-S122位点的O-GlcNAc修饰来使其降解
为了探讨circVPRBP是否通过蛋白酶体介导的蛋白质降解诱导RACK1蛋白下调,研究者首先使用蛋白酶体抑制剂MG132处理宫颈癌细胞,当蛋白降解被MG132处理阻断时,过表达或干扰circVPRBP不改变RACK1蛋白水平(图6A,B)。用CHX蛋白合成抑制剂处理后,过表达circVPRBP加速了RACK1蛋白的降解,沉默有相反效果(图6C),此外,circVPRBP过表达导致RACK1蛋白的多泛素化显著增加(图6D)。先前的文献表明,O-GlcNAc糖基化修饰影响RACK1的稳定性,那么circVPRBP是否影响RACK1的O-GlcNAc修饰呢?免疫共沉淀(Co-IP)发现circVPRBP过表达显著降低了RACK1的O-GlcNAc(RL2)水平,并降低了O-GlcNAc转移酶(OGT)与RACK1之间的结合(图6E),沉默circVPRBP有相反结果(图6F)。RACK1的S122-O-GlcNAc位点突变使circVPRBP不再促进RACK1降解(图6G)。RNA pull down分析发现,缺失WD3区的RACK1突变体(ΔWD3-RACK1-flag)不能与circVPRBP结合,表明WD3区域包含circVPRBC结合位点。CoIP实验也表明,ΔWD3-RACK1不能与OGT结合,说明WD3区域也包含OGT结合位点(图6H)。这些结果表明circVPRBP通过阻断RACK1的S122位点O-GlcNAc糖基化介导RACK1降解。
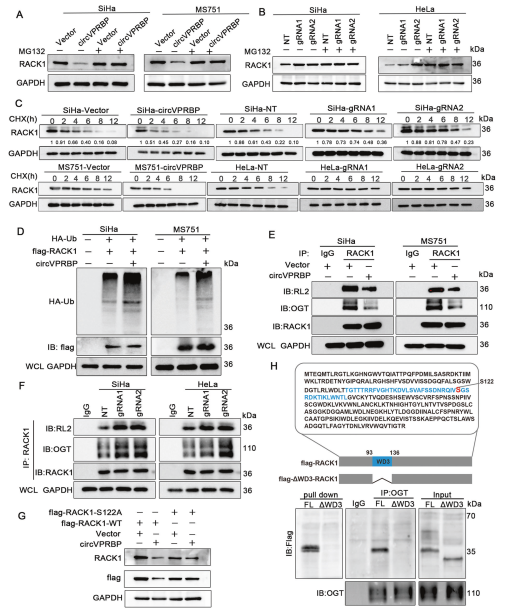
图6
6. CircVPRBP以RACK1-依赖的方式抑制宫颈癌的淋巴结转移
接下来,通过挽救试验分析了circVPRBP是否以RACK1依赖的方式抑制细胞的淋巴转移。在宫颈癌细胞中使用Tet-on诱导系统来诱导RACK1表达,同时过表达circVPRBP或空载体(图7A),也构建了相应的异种移植小鼠腘窝淋巴结转移模型。结果显示Dox诱导的RACK1逆转了circVPRBP对淋巴结转移的抑制作用(图7B),circVPRBP过表达组的腘窝淋巴结体积明显小于对照组,并且Dox诱导的RACK1组的淋巴结体积大于空载体和circVPRBP过表达组(图7C)。角蛋白免疫染色实验表明,circVPRBP过表达显著抑制了宫颈癌细胞向腘窝淋巴结转移的能力,Dox诱导的RACK1逆转了这一趋势(图7D、E)。此外,Dox诱导的RACK1在体内和体外显著逆转了circVPRBP对淋巴管生成的抑制作用(图7F–I)。这些结果说明circVPRBP通过参与RACK1降解来抑制宫颈癌淋巴结转移和淋巴管生成。
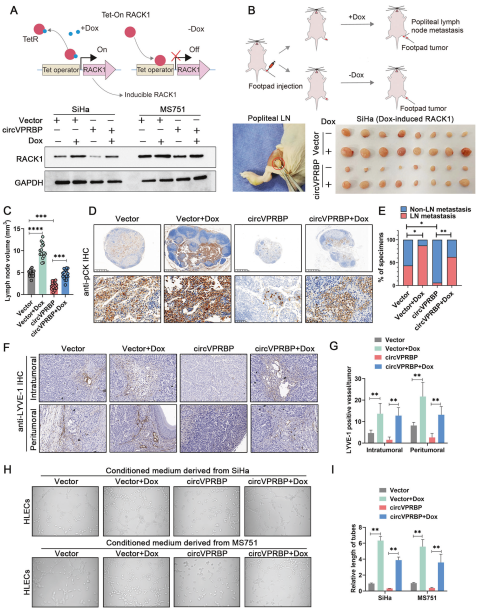
图7
此外,研究者还构建了体内皮下异种移植模型来确定circVPRB对宫颈癌细胞的增殖抑制是否也通过RACK1起作用。结果显示,Dox诱导的RACK1逆转了circVPRB过表达对肿瘤生长的抑制(图8A-C)。体外细胞实验也发现Dox诱导的RACK1消除了circVPRBP对细胞增殖和侵袭的抑制(图8D-I),逆转了circVPRBP对Galectin-1、pAKT和pFAK表达水平的抑制(图8J)。在宫颈癌患者中,低circVPRBP表达和高RACK1表达存在负相关性(图8K)。这些研究结果表明,circVPRBP通过促进RACK1的降解来抑制宫颈癌淋巴结转移。
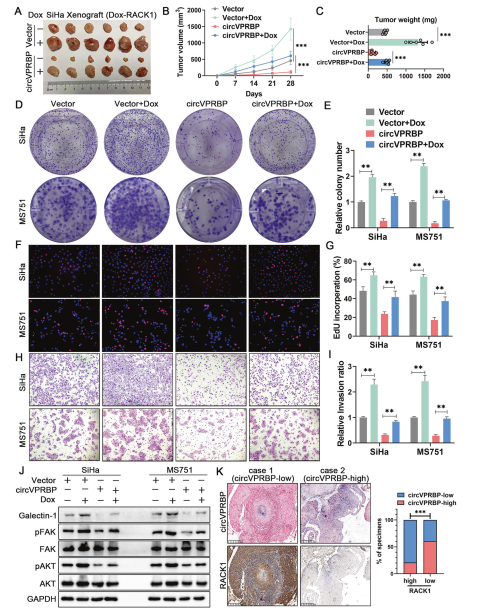
图8










 实验热线:4006991663
实验热线:4006991663












