中文标题:捕获新转录RNA的相互作用体,或促进对不同细胞和系统中总RNA结合蛋白质组的深入研究
发表期刊:Nature Methods
影响因子:28.467
合作单位:中国科学院广州生物医学与健康研究所
运用技术:LC-MS/MS蛋白质谱鉴定(由辉骏生物提供技术支持)
● 研究背景
目前系统研究RNA结合蛋白质组的方法主要是基于捕获多聚腺苷酸(PolyA)RNA,主要是带有寡聚(DT)包被珠的mRNA。然而PolyA尾巴只在新转录的RNA成熟的过程中被添加到RNA中,而一些成熟的mRNA要么是非PolyA的,要么是双态的。此外,成熟的非PolyA
RNA物种占所有转录序列的很大一部分。捕获与所有类型RNA相互作用的RNA结合蛋白的方法不仅可以扩大我们目前对RNA相互作用组的看法,而且有助于理解非Polya
RNA在生理和疾病中的功能。
● 研究结果
1. 利用RICK技术捕获新转录的RNA互作组
研究者用Eu标记HeLa细胞中的RNA,固定细胞后通过点击反应使Eu生物素化,然后用链霉亲和素包裹的珠子提取RNA-蛋白质复合物。凝胶电泳和银染证实Rick方法成功分离出与EU标记RNA直接相互作用的蛋白质。Western
blotting验证了Rick对已知RNA相关蛋白的捕获。
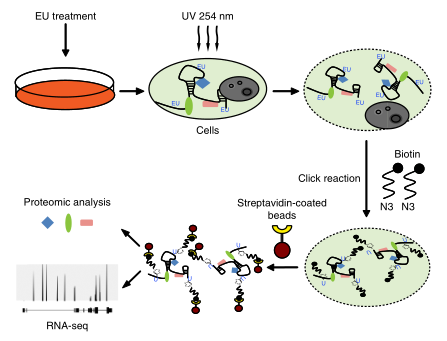
图1
2. Rick捕获的RNA种类
研究者对Rick
pull
down样本进行了RNA测序(RNA-seq),分析结果(图2A)与Castello的oligo(DT)捕获数据相比显示出明显的差异,在该数据中,捕获的RNA中80%是mRNA。接下来,研究者研究了Rick样本中的富集与三种相关的非PolyA
RNA:CircRNA、近端启动子RNA(ppRNA)和增强子RNA(ERNA)的oligo(Dt)捕获情况。在对ppRNA的评估中,与oligo(Dt)捕获相比,Rick样本中转录暂停基因(TR>4)在TSS周围积累了更高的RNA-seq信号,这表明仅通过Rick就能有效地分离ppRNA;而非暂停基因(TR<4)差异则很小(图2B,C)。此外,在Rick样本中,RNA-seq信号在假定的增强子区域16(6.05%)上有很强的富集,而在寡核苷酸(DT)捕获中几乎没有(0.11%)(图2D)。RT-qPCR进一步证实,与oligo(Dt)捕获相比,用Rick提取的非Polya
RNA分离效果良好。简言之,除Polya
RNA外,Rick还成功地分离出了其他各种RNA种类,表明它也可以富集不是通过寡核苷酸(DT)捕获方法分离的相关结合蛋白。
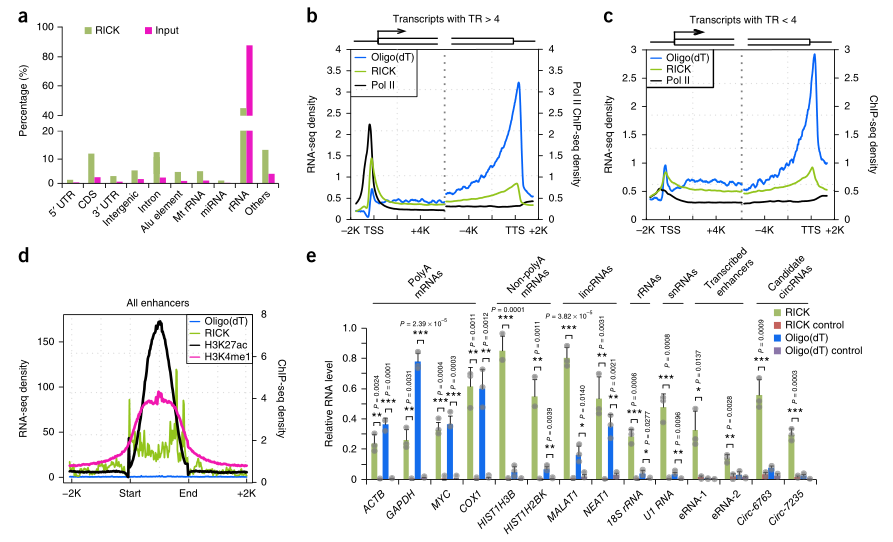
图2
3. RICK法分离蛋白质的特性研究
采用液相色谱-串联质谱(LC-MS/MS)对Rick分离的蛋白质进行分析。与oligo(DT)捕获在不同条件下的比较表明,Rick分离了许多在oligo(DT)捕获研究中没有鉴定到的蛋白质)(图3B),这些差异既不是由于细胞培养、蛋白质组学程序的差异,也不是由Eu标记引起的(图3A)。
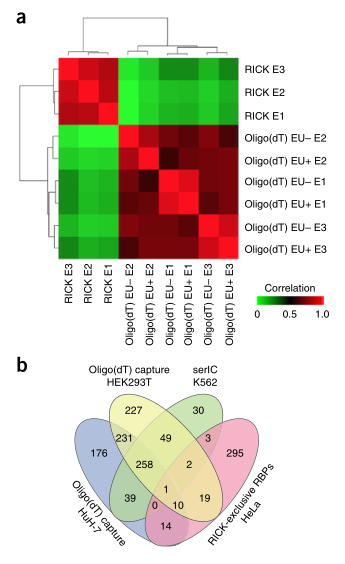
图3
4. RICK分离蛋白的功能分析
对295个RICK特有的RBP进行了GO分析,观察了与有丝分裂相关的生物过程的富集(图4A)。KEGG途径分析还将“细胞周期”列为前十个最显著富集的途径(图4B)。相反,对Rick鉴定的425种蛋白质进行的GO和KEGG分析显示,oligo(dT)捕获数据集中存在的蛋白质主要与RNA相关。综上所述,这些数据进一步加强了Rick在分离用寡核苷酸(DT)捕获方法未鉴定出的蛋白质方面的独特性,并揭示了RNA在意想不到的细胞过程中的功能。
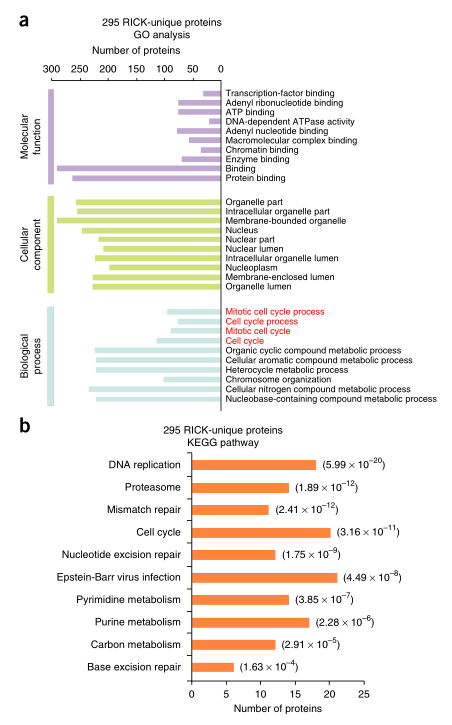
图4
5. RICK识别与非polyA RNA优先结合的蛋白质
考虑到通过Rick和oligo(DT)捕获分离的RNA种类的显著差异,295个RICK特有的RBP中有相当一部分可能优先与非polyA
RNA结合。这种特异性可能是由于化学计量学、亚细胞定位或潜在的内在结合特异性。LC-MS/MS鉴定出914个高置信度蛋白质,称之为“PolyA缺失型Rick蛋白”。在这914个蛋白质中,576个与标准Rick程序的720个高置信度蛋白质重叠(图5A)。进一步分析表明,295个RICK特有的RBP中有204个(69.2%)与914个PolyA缺失型Rick蛋白重叠(图5B)。此外,在710个与RICK特有RBP不重叠的710个polyA缺失型RICK蛋白中,有563个出现在oligo(DT)捕获数据集中(图5B),这表明这些蛋白具有结合PolyA和非PolyA
RNA的混合趋势。这些结果表明,Rick可用于鉴定优先与非Polya RNA结合的蛋白质。
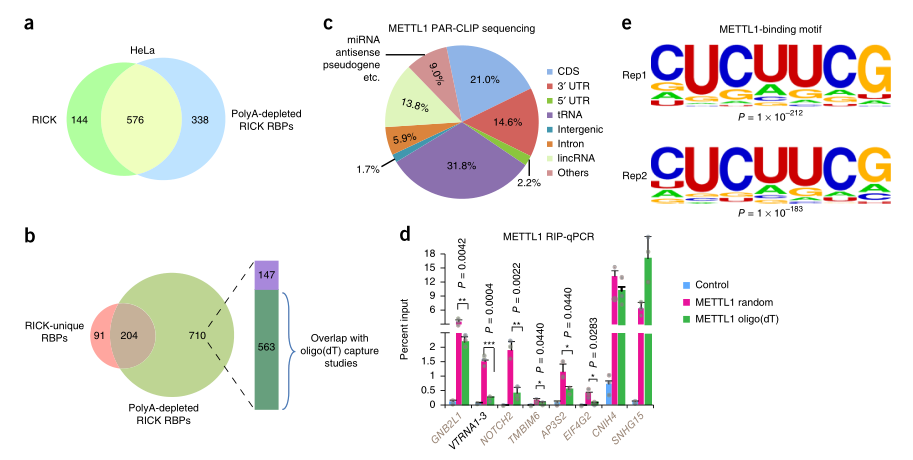
图5
6. 与METTL1和CDK1相互作用的RNA特性
我们选择了两个Rick特有的RBP
METTL1和CDK1,用PAR-CLIP测序方法研究了它们相互作用的RNA。METTL1的两个独立PAR-CLIP测序实验显示捕获的RNA存在广泛重叠,其中很大一部分也被RICK捕获。进一步分析证实METTL1与tRNA显著结合,还与多种推测为非polyA的RNA结合,如内含子RNA和从基因间区域转录的RNA(图5C)。接下来,研究者使用随机六聚体或寡聚体(dT)引物进行RNA免疫沉淀(RIP),然后进行RT-qPCR,以识别METTL1靶RNA是否具有polyA尾巴。RIP-qPCR显示,使用随机六聚体富集了7个mRNA,而使用寡聚(DT)引物只能扩增出其中的3个,证实了METTL1与含有mRNA序列的非PolyA
RNA结合(图5D)。CDK1
PAR-CLIP测序分析显示与转录自基因间区域和内含子RNA的RNA结合,与RICK捕获的RNA也存在广泛重叠。后续分析进一步表明,METTL1和CDK1广泛地与非PolyA
RNA结合,暗示这两种蛋白的RNA相关功能被忽视。
7. 利用RICK捕获新生RNA互作组
研究者对HeLa细胞进行了短Eu标记(0.5、1和2小时),以研究Rick是否可以捕获与新生RNA互作的蛋白。鉴定了208种不同的高置信度蛋白质(分别为149、119和143,作用时间分别为0.5、1和2小时),称之为“新生富集RBP”和319种低置信度蛋白质(图6A)。对208个新生富集RBP进行的GO和KEGG通路分析显示,转录和RNA代谢相关术语显著丰富(图6B)。进一步的研究表明,新生RNA转录和局部代谢物产生之间存在联系,从而调节表观基因和潜在的表观转录基因。
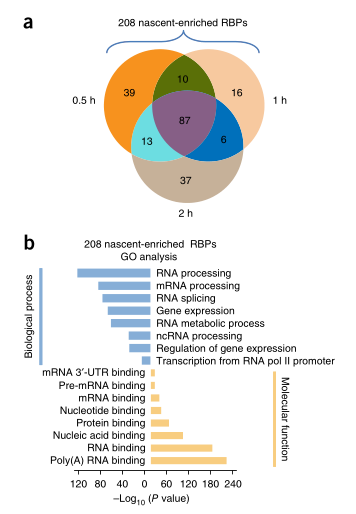
图6
8. 利用RICK获取mESC总RNA互作组
为证明Rick可以应用于其他类型的细胞,研究者用链霉亲和素结合辣根过氧化物酶证实了Eu在mESC中的有效掺入,并进行了LC-MS/MS,鉴定出518个高置信蛋白和304个低置信蛋白。这518个高置信度蛋白质中有160个与Kwon等人报告的“mESC
mRNA相互作用组”重叠,而358个是RICK独有的,因此将其称为RICK独有的mESC
RBP。对这358个候选限制性商业惯例的GO分析显示,RNA结合或PolyA
RNA结合术语丰富。在这358个蛋白中,有95个在mESC中的表达水平高于分化后的细胞,这表明mESC在自我更新或多能性方面具有潜在的作用。因此,Rick可以应用于HeLa以外的不同细胞类型;此外还需要进一步的研究来确定新发现的候选RBP在mESC自我更新/多能性中的作用。











 实验热线:4006991663
实验热线:4006991663