中文标题:植物ESCRT组分FREE1穿梭到细胞核以减弱脱落酸信号
发表期刊:Nature Plants
影响因子:13.256
合作单位:华南师范大学
运用技术:IP-MS/MS磷酸化位点检测(由辉骏生物提供技术支持)
● 研究背景
内吞体分选转运复合体(ESCRT)是真核生物中存在的保守的囊泡运输调控机器,由20多个蛋白组成并分成ESCRT-0,
-I, -II,
-III以及VPS4/SKD1-LIP5等5个蛋白复合物,它们协同作用识别泛素化修饰的膜蛋白并将其分选到细胞内多泡体(MVB)的内小泡中,这样当多泡体与液泡融合后,膜蛋白即被运输至液泡内腔而被降解。已有研究表明,ESCRT蛋白参与了植物激素脱落酸(ABA)的信号转导。作者团队前期已经发掘了植物特有的ESCRT复合物组分FREE1,并解析了其调控膜蛋白转运和自噬降解的功能,而有关ESCRT蛋白通过何组分以及哪种途径参与植物激素脱r落酸(ABA)的信号转导,仍有待进一步研究。
● 研究结果
1. 通过使用新创建的free1-ctmut植物,发现FREE1的C-末端盘绕线圈结构域赋予ABA超敏反应
在这项研究中,研究者利用CRISPR-Cas9技术绕过FREE1功能缺失的致死性,得到一个特异影响FREE1蛋白入核的突变体Free1-ctmut。Sanger测序结果显示该突变体倒数第二个外显子内有8bp的缺失(图1A),这导致FREE1蛋白序列在581个氨基酸位点上有一个提前终止密码子,引入了558-581个氨基酸残基的外源多肽(图1B)。WB分析检测到Free1-ctmut植物中较小的内源FREE1,表明产生了截短的FREE1蛋白,并缺失了羧基末端的尾巴(图1C)。Free1-ctmut突变体在正常生长条件下没有表现出明显的表型,但与野生型(WT)植株相比,对ABA介导的抑制成苗和ABA诱导的离体叶片衰老表现出更高的敏感性。
FREE1蛋白有三个已知的结构域,包括氨基末端的固有无序区、FYVE结构域和C-末端卷曲圈区。为了深入了解FREE1蛋白不同结构域在介导Free1-ctmut植株脱落酸(ABA)敏感性中的作用,本研究将4个不同版本的绿色荧光蛋白分别与FREE1、Free1-ctmut、FREE1(∆FYVE)和FREE1(∆CC)融合到Free1-ctmut中,并对其进行了表型分析。如图1D-F所示,全长FREE1完全补充了Free1-ctmut的ABA敏感表型,而C-末端截短的Free1-ctmut和FREE1(∆CC)未能补充Free1-ctmut的表型,突出了FREE1
C末端在赋予Free1-ctmut植物的ABA超敏感表型中的功能重要性。先前的研究发现,FREE1的N端部分负责其与ABA受体的相互作用,而这个新建立的Free1-ctmut植物中,缺失部分位于C端卷曲区域(图1),理论上不影响FREE1与ABA受体的相互作用。因此,Free1-ctmut的ABA超敏反应不太可能是由MVB介导的空泡分选缺陷和ABA受体的降解引起的。研究者通过杂交实验进一步验证猜想,并得出结论:Free1-ctmut作为ESCRT组分正常发挥作用,FREE1通过C末端负性调节ABA反应,其机制不同于先前报道的FREE1调节ABA受体内体分选的功能。
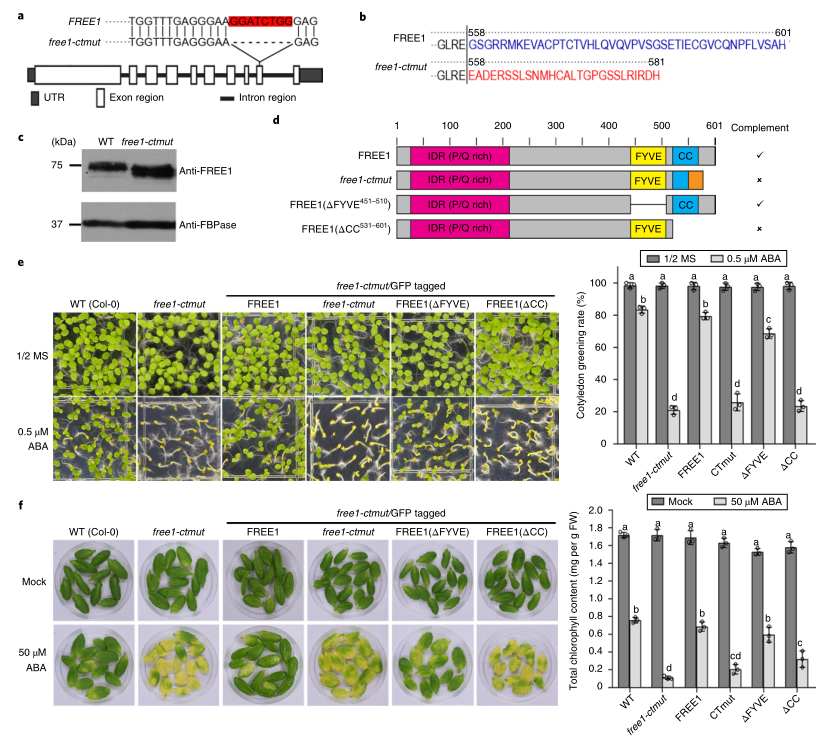
图1
2. ABA促进FREE1核输入,核定位的FREE1补充FREE1-ctmut对ABA的超敏反应
接下来,研究者使用先前建立的GFP-FREE1/FREE1互补系观察了FREE1亚细胞定位模式对ABA的响应。有趣的是,ABA处理导致在共聚焦显微镜下观察到的细胞核中GFP-FREE1的水平显著增加,并在免疫印迹分析中检测到。(图2A,B)。此外,WT植株细胞核中内源FREE1水平的增加对ABA的响应进一步支持了ABA促进FREE1核进入的结论(图2C)。此外,在GFP-FREE1-CTmut/Free1-ctmut系(图2D)中,细胞核中GFP-FREE1-CTmut的水平没有明显增加。此外,FREE1抗体的WB分析进一步证实,内源FREE1-CTmut蛋白未能对ABA做出反应而移位到细胞核(图2E)。这些结果表明,FREE1可能通过其在细胞核内的作用发挥其对ABA信号的抑制作用,而FREE1的C末端对于其穿梭到细胞核和植物对ABA的响应是必不可少的。为了提高FREE1在细胞核中的表达水平,研究者建立了GFP-FREE1-NLS/FREE1-ctmut和GFP-FREE1-NES(Mut)/FREE1-ctmut转基因株系。GFP-FREE1-NLS显示显性的细胞核定位,而GFP-FREE1-NES(Mut)在没有ABA处理的情况下核定位明显增加(图2F)。进一步的表型分析表明,GFP-FREE1-NLS和GFP-FREE1-NES(Mut)都能够补充FREE1-ctmut对ABA的超敏表型(图2G,H)。综上所述,ABA处理促进了FREE1的核积累,但不促进FREE1-CTmut的核积累,次外,FREE1的核积累能够补充FREE1-ctmut对ABA的敏感表型。
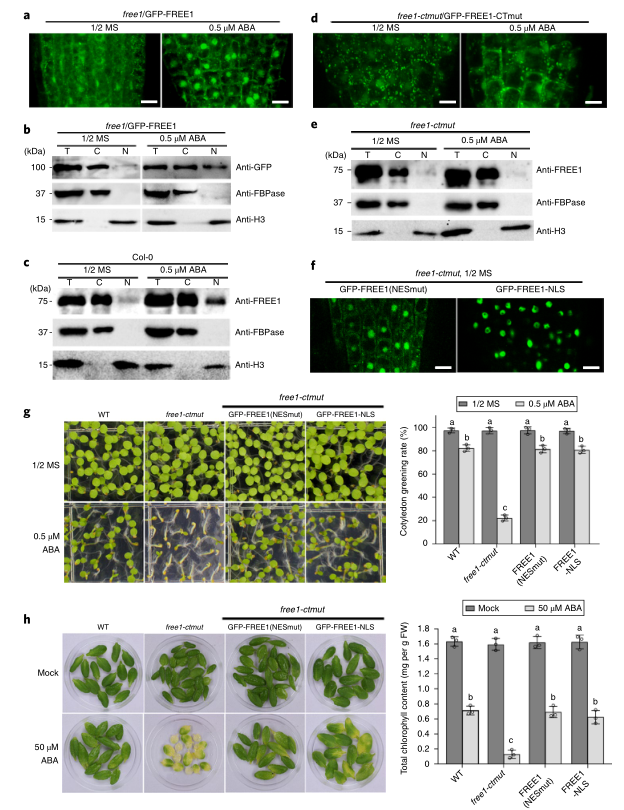
图2
3. ABA促进FREE1磷酸化,磷酸化的FREE1主要定位于细胞核
大量研究表明,磷酸化修饰可调节蛋白质核质穿梭。为了验证FREE1在用ABA处理时是否会发生磷酸化修饰,研究者检测了有或没有ABA处理的FREE1的磷酸化水平,结果显示ABA处理显著增加了FREE1的磷酸化水平(图3A)。在GFP-FREE1CTmut/FREE1-CTmut系中检测FREE1-CTmut的磷酸化水平,结果表明,FREE1-CTmut磷酸化水平的增加远小于FREE1(图3A),这表明ABA诱导的FREE1磷酸化需要C端。接下来,研究者在核和胞质组分中检测有无ABA处理的FREE1磷酸化水平,结果表明,磷酸化的FREE1主要位于细胞核中(图3B),表明FREE1可能需要进行磷酸化修饰才能在细胞核中积累。后续的时程和剂量反应实验也进一步表明,ABA能够诱导FREE1磷酸化,这需要FREE1的C末端;磷酸化的FREE1主要位于细胞核中。
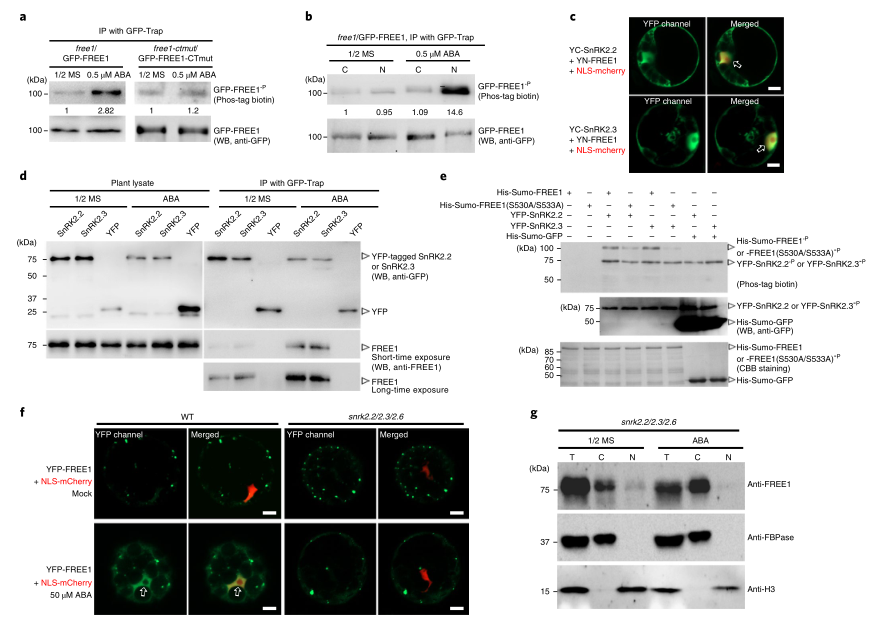
图3
4. 依赖于SnRK2.2/2.3的FREE1磷酸化是ABA诱导的FREE1核输入所必需的
多研究表明,SnRK2分支蛋白激酶,包括SnRK2.2、SnRK2.3和SnRK2.6,是介导植物对ABA反应的关键正调控因子,ABA强烈激活ABA以进一步磷酸化下游因子。为了测试SnRK2激酶是否磷酸化FREE1对ABA的响应,研究者通过双分子荧光互补(BIFC)等分析证实了FREE1与SnRK2.2/2.3在拟南芥叶片原生质体的细胞核和胞浆中的相互作用(图3C)。Co-IP结果表明,ABA处理增强了FREE1与SnRK2.2和SnRK2.3之间的联系(图3D)。接下来,研究者利用几个含有结构域截断的FREE1突变体,用于与SnRK2的相互作用分析。结果表明,FREE1的C-末端卷曲区负责与SnRK2.2和SnRK2.3的相互作用。
接下来,研究者进行了体外磷酸化实验,以测试SnRK2激酶是否直接磷酸化FREE1。将纯化的His-SUMO-FREE1分别与ABA处理的转基因植物GFP-SnRK2蛋白和大肠杆菌His-MBP-SnRK2蛋白孵育。在这两种情况下,His-SUMO-FREE1的磷酸化都很容易检测到(图3E)。此外,体内外实验结果表明,SnRK2.2和SnRK2.3是ABA诱导FREE1磷酸化的预期激酶蛋白。为了进一步揭示ABA诱导和SnRK2S依赖的FREE1磷酸化是否与ABA诱导的FREE1核导入有关,研究者将GFP-FREE1导入现有SnRK2.2/2.3/2.6三重突变体的叶片原生质体中,在ABA处理后的SnRK2.2/2.3/2.6原生质体中没有观察到明显的FREE1核导入增加(图3F)。这一观察结果得到证据的支持,即在ABA处理后,SnRK2.2/2.3/2.6三重突变体细胞核中内源性FREE1的水平没有明显增加(图3G)。综上所述,这些结果表明,依赖于SnRK2.2和SnRK2.3的FREE1磷酸化对于ABA诱导的FREE1核进口是必要的。
5. ABA诱导的FREE1核进口需要丝氨酸残基S530/S533的磷酸化
为了确定相应的FREE1磷酸化残基对ABA的响应,研究者对免疫沉淀的GFP-FREE1和GFP-Free1-ctmut蛋白进行了质谱分析。结果显示,在GFP-Free1-ctmut蛋白中检测到的两个磷酸化位点S530和S533位于FREE1
C-末端卷曲圈区,而GFP-FREE1-CTmut蛋白中检测不到。Free1-ctmut蛋白的缺失可能破坏了盘绕区域的结构,从而降低了S530和S533的磷酸化。因此,我们将目前的研究重点放在S530和S533在诱导ABA反应中的功能特性上。
为了进一步验证S530和S533的磷酸化是否参与了ABA诱导的FREE1核输入,我们将YFP-FREE1(S530A/S533A)和YFP-FREE1(S530D/S533D)这两个丝氨酸位点突变为非磷酸化的丙氨酸或磷酸化的天冬氨酸残基,引入到FREE1突变株中,进行FREE1定位观察和植物表型分析。对ABA处理和未处理的植株不同蛋白质组分的共聚焦观察和免疫印迹分析均未发现YFP-FREE1(S530A/S533A)在细胞核内明显积聚(图4B,C)。相反,YFP-FREE1(S530D/S533D)在没有ABA处理的补充植株中表现出明显的核积累(图4D,E)。此外,与免疫沉淀-质谱结果一致,ABA处理的转基因植株和体外磷酸化实验中纯化的His-SUMO-FREE1(S530A/S533A)的YFPFREE1(S530A/S533A)的磷酸化水平都明显降低(图3E、4F)。YFP-FREE1(S530A/S533A)/Free1-ctmut表现出与Free1-ctmut相似的ABA过敏性,而YFP-FREE1(S530D/S533D)/Free1-ctmut在成苗和ABA诱导的叶片衰老方面与WT相似(图4G,H),进一步支持S530/S533的磷酸化是必需的。
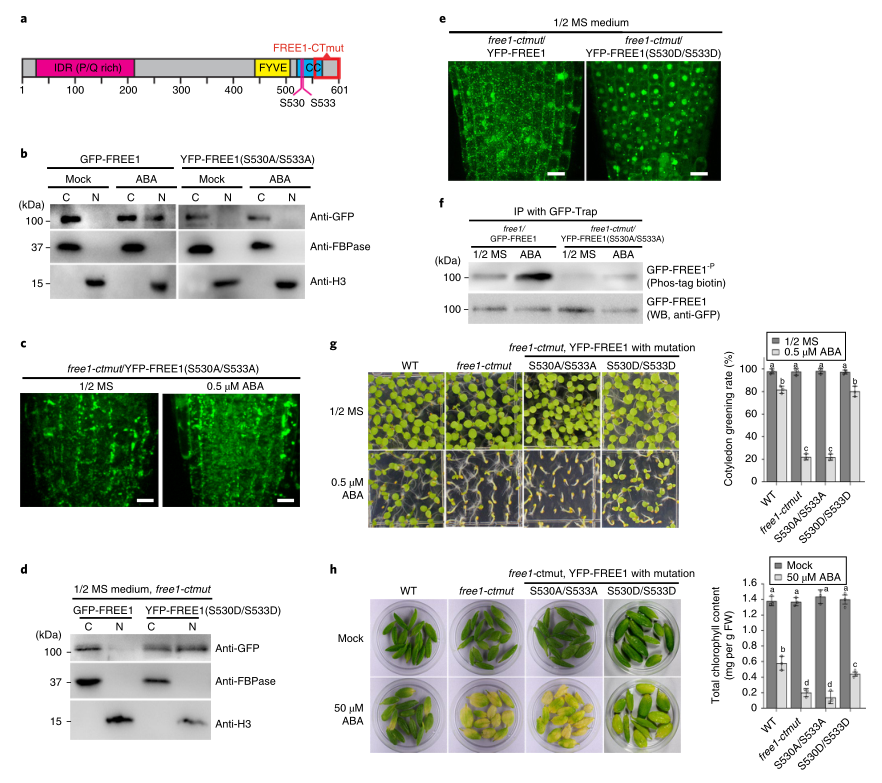
图4
6. FREE1通过抑制ABF4和ABI5的DNA结合能力来抑制ABF4和ABI5的转录活性
为了研究FREE1在细胞核中的功能对ABA的响应,研究者以FREE1(231-601)的C末端部分为诱饵,在拟南芥互补DNA文库中进行了酵母双杂交筛选,在阳性克隆鉴定了编码转录激活因子ABF4和ABI5的克隆,用于进一步的蛋白质相互作用分析。酵母双杂交结果显示,ABF4和ABI5都与FREE1(231-601)相互作用(图5A),BIFC分析进一步证实了这种相互作用(图5B)。在酵母双杂交试验中进一步的精细定位表明,Free1-ctmut(231-581)失去了与ABF4和ABI5的相互作用,而缺失了N末端的FREE1(421-601)仍然可以与这些转录因子相互作用。这些结果表明,FREE1的C端螺旋结构域专门负责与ABF4和ABI5的DNA结合域的相互作用(图5A)。免疫共沉淀试验表明,在没有ABA的情况下,FREE1与ABF4或ABI5之间的相互作用很弱,但在ABA处理后得到加强(图5C,D)。这些结果表明,FREE1C-末端残基的磷酸化在调节ABA反应中起着重要作用。
为了确定FREE1是否影响ABF4和ABI5在植物细胞中的转录激活活性,研究者在拟南芥原生质体中进行了双荧光素酶的报告实验。结果表明,在ABF4或ABI5单独存在的情况下,ABA显著诱导PAO1或EM6的表达,当与GFP-FREE1共表达时,这种诱导被显著抑制,但与GFP对照(图5E,F)不同,这表明FREE1直接抑制ABF4和ABI5对ABA的转录激活活性。接下来,为了检测FREE1是否通过竞争性结合ABF4和ABI5转录因子的DNA结合域来抑制这两种转录因子的转录激活活性,研究者通过电泳迁移率改变分析(EMSA)研究了FREE1对这两种转录因子与下游基因顺式调控序列结合活性的影响。结果表明,FREE1,而不是GFP对照,以剂量依赖的方式抑制ABF4和ABI5的DNA结合能力(图5G,H),说明了FREE1对ABF4和ABI5转录激活活性的直接抑制作用。利用ChIP-qPCR方法进一步检测Free1-ctmut突变是否会导致GFP-ABF4和GFP-ABI5对其靶基因启动子序列的富集作用增强,并以GFP为阴性对照。结果表明,FREE1确实减弱了ABF4和ABI5对下游靶基因启动子区域的DNA结合能力(图5I,J)。
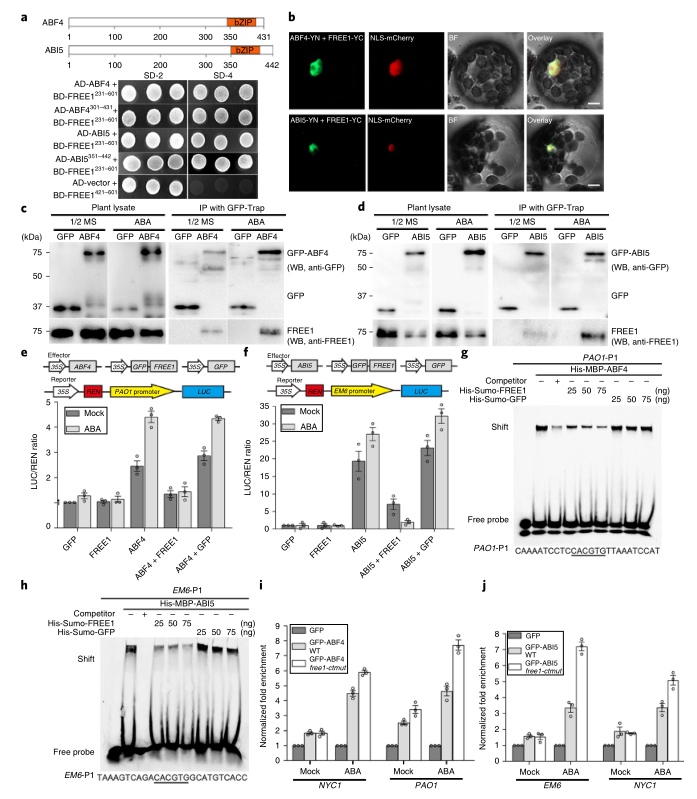
图5
7. ABF4或ABI5的缺失挽救了在Free1-ctmut突变体中产生的ABA超敏表型
Free1-ctmut突变体对ABA的超敏表型很可能主要是由于ABF4和ABI5在细胞核内过度激活而没有FREE1抑制所致。为了证实这种可能性,研究者测试了ABF4或ABI5的缺失是否会通过使Free1-ctmut与ABF4或ABI5突变体杂交来挽救在Free1-ctmut突变体中观察到的ABA超敏表型。与预期一致,Free1-ctmut的ABF4或ABI5突变在成苗和ABA诱导的叶片衰老方面都表现出WT
ABA反应(图6A,B),即Free1-ctmut的ABA敏感表型可能是由ABF4和ABI5转录活性的过度激活引起的。此外,接下来,研究者检测了ABA反应基因NYE1、NYC1、PAO1、RD29A、RD29B、NYE2和SAG29在WT、Free1-ctmut突变体ABF4、ABI5、Free1-ctmut/ABF4和Free1-ctmut/ABI5中的相对表达水平。结果显示,所有检测到的基因在未经ABA处理的Free1-ctmut突变体中的表达均升高,而在ABA处理下,表达诱导的升高更为显著。然而,ABF4或ABI5突变消除了Free1-ctmut中ABA反应基因的这种表达诱导(图6C,D)。总之,这些结果表明,在Free1-ctmut中ABA反应基因的表达上调是由于ABF4和ABI5转录活性的过度激活所致。
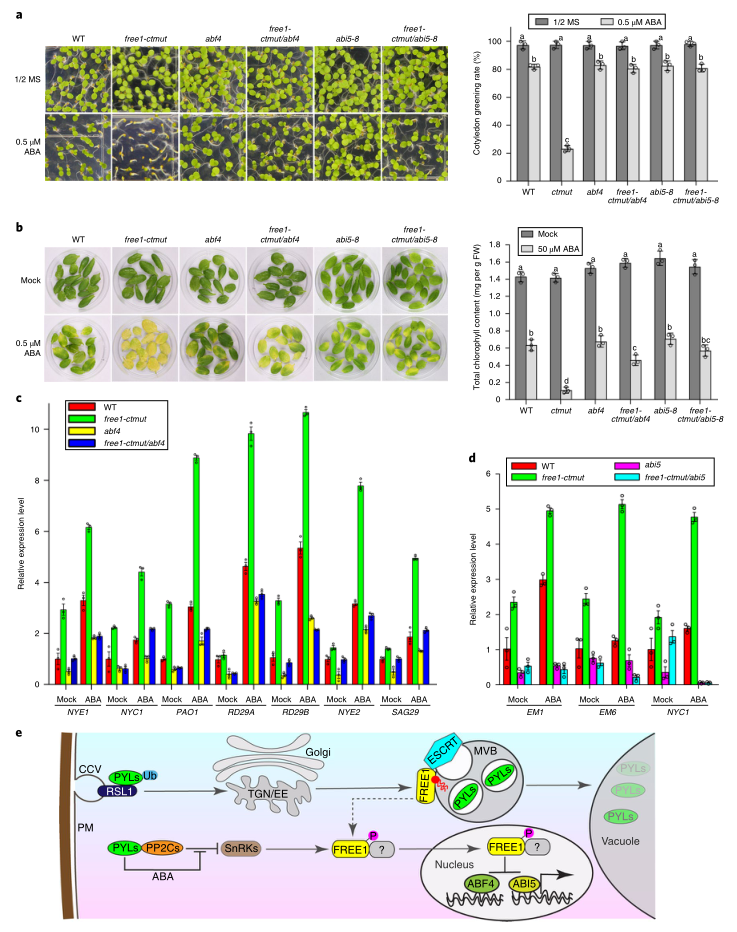
图6
● 结论
研究在转录水平上证明了细胞膜转运和ABA信号之间的串扰,并强调了植物ESCRT亚基FREE1的兼职特性,它除了在细胞质中的膜转运中发挥作用外,还在细胞核中进化了独特的非内体功能。









 实验热线:4006991663
实验热线:4006991663