中文标题:三阴性乳腺癌凋亡细胞胞外囊泡中的CXCL1蛋白通过激活TAM/PD-L1信号传导促进癌转移
发表期刊: J Exp Clin Cancer Res
中科院分区:1区
影响因子:11.3
发表时间:2024年4月
合作单位:广东省中医院
运用技术:DNA pull down-MS(由辉骏生物提供技术支持,点击查看服务详情)
【研究内容】:
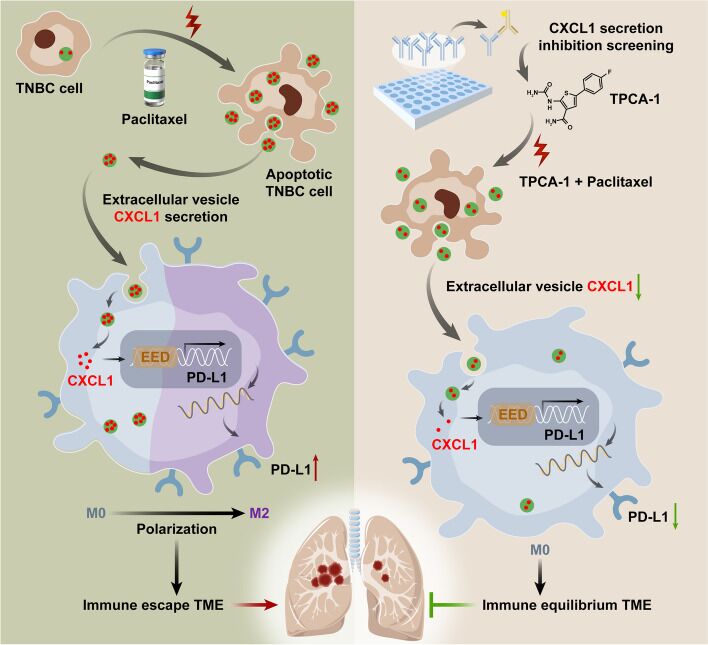
2024年4月,广东省中医院的研究人员发现:三阴性乳腺癌(TNBC)凋亡细胞胞外囊泡中的CXCL1蛋白能与PD-L1启动子结合,并转录激活EED介导的PD-L1启动子活性来增强TAM/PD-L1信号转导,此外,TPCA-1可以作为改善TNBC预后的靶向候选药物。辉骏生物为客户提供DNA pull down MS实验技术服务。
【研究背景】:
三阴性乳腺癌(TNBC)是最具侵袭性的乳腺癌亚型,化疗可以诱导细胞死亡,是该疾病的基础治疗方法。值得注意的是,新证据表明,垂死细胞释放的信号可能通过调节周围的微环境来诱导癌症的进展和转移。然而,潜在的分子机制和靶向策略尚未被探索。
【研究路线】:
1. 细胞实验发现TNBC凋亡细胞的胞外囊泡(EV-dead)可诱导TNBC肺转移
2. 功能分析表明EV-dead通过诱导巨噬细胞M2极化来促进TNBC细胞的转移和化疗耐药
3. 趋化因子阵列分析鉴定了EV-dead的关键分子CXCL1
4. 表达分析显示EV-dead中CXCL1通过激活PD-L1表达诱导巨噬细胞M2极化
5. CXCL1调低会抑制EV-dead诱导的TNBC生长和肺转移
6. DNA pull down MS等实验发现CXCL1通过结合PD-L1启动子促进巨噬细胞中PD-L1的表达
7. 体内体外实验证实CXCL1抑制剂TPCA-1可显著抑制EV-dead诱导的化疗耐药和TNBC肺转移
【结论】:
三阴性乳腺癌(TNBC)是最具侵袭性的乳腺癌亚型。TNBC凋亡细胞胞外囊泡的趋化因子阵列分析发现:胞外囊泡中的CXCL1是激活TAM/PD-L1信号通路的关键成分,CXCL1的敲低可显著抑制胞外囊泡诱导的TNBC生长和转移。DNA‑pull down MS和Luc等实验也确定了CXCL1能与PD-L1启动子结合,促进PD-L1启动子活性来增强TAM/PD-L1信号转导。此外,TPCA-1可以作为改善TNBC预后的靶向候选药物,且无明显毒性。











 实验热线:4006991663
实验热线:4006991663






