中文标题:FEN1促进非小细胞肺癌肿瘤进展并增强顺铂耐药性
发表期刊:Molecular Oncology
影响因子:5.314
发表时间:2017年2月
合作单位:南京师范大学生命科学学院
运用技术:慢病毒包装(由辉骏生物提供技术支持)
● 研究背景
肺癌是全球男性和女性癌症相关死亡的主要原因,非小细胞肺癌(NSCLC)约占肺癌病例的85%。如今在临床治疗中,大多数抗癌剂通过干扰DNA复制或诱导DNA损伤的方式来杀死细胞,进而导致细胞凋亡。在这些抗癌药物中,顺铂代表了癌症临床治疗史上一个成功的里程碑。然而,由于癌细胞中高效的DNA复制和修复系统,顺铂的疗效并不充分,耐药机制也有待于进一步研究。
以往的报道表明,癌症对DNA损伤诱导剂的耐药性与癌细胞中DNA修复酶的表达升高有关。DNA翻盖内切酶1(FEN1)是DNA修复途径中的关键分子,鉴于顺铂诱导的DNA加合物链内交联主要由NER修复,我们推测抑制FEN1表达或抑制FEN1活性可能增强顺铂的治疗效果。鉴于FEN1在DNA复制中的作用,推测FEN1可能是肺癌细胞增殖所必需的。FEN1参与了NER和其他DNA修复途径,说明靶向FEN1可能是克服肺癌对顺铂耐药性的潜在途径。FEN1抑制剂或可单独作为阻断癌细胞增殖的药物,或者与DNA损伤诱导剂联合使用,以提高治疗效果。
● 研究结果
1. FEN1在肺癌细胞中上调并与预后不良相关
作为DNA复制的重要参与者,FEN1可能在癌症组织中上调表达。研究者通过数据库比较了癌组织和正常组织中FEN1的表达水平,结果表明,肺癌组织中FEN1 mRNA的表达水平显著高于正常组织(图1A)。研究者进一步通过免疫组织化学(IHC)分析比较了正常组织和肺癌样本中FEN1蛋白的表达水平,证实了这一观察结果(图1B)。在正常组织中,FEN1评分低于100分的患者占85%,这一比例明显低于癌组织。相反,癌组织中FEN1评分在200分以上的患者比例明显高于正常组织。数据库数据分析结果表明,肺癌的恶性程度随着FEN1表达水平的增加而升高(图1D),这说明肺癌的恶性程度与FEN1的过度表达有关。相应地,FEN1水平高的患者总体生存时间明显短于FEN1水平低的患者(图1E)。这些结果提示FEN1在肺癌中表达上调,与肿瘤恶性程度和预后不良有关。
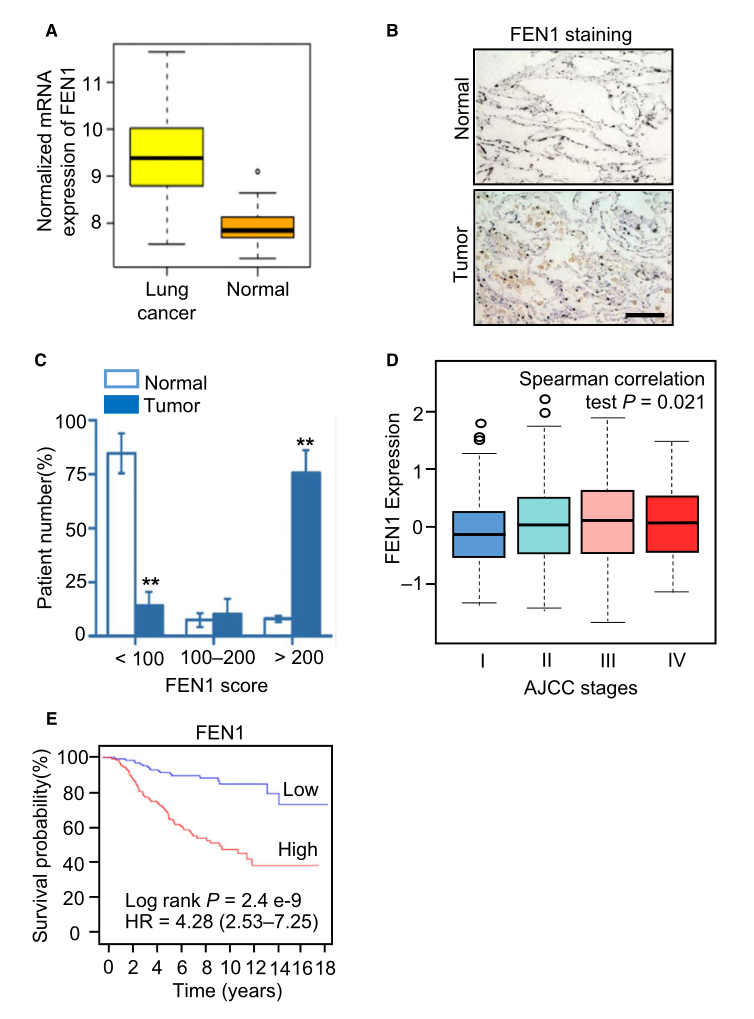
图1
2. FEN1促进肿瘤的体内外进展
本研究选择A549细胞作为非小细胞肺癌药物代谢研究的体外模型。上述数据已经表明FEN1的过度表达与癌症有关,但FEN1的高表达是否会影响肿瘤进展尚不清楚。研究者比较了FEN1被siRNA下调的A549细胞的增殖率(图2A)和FEN1异位过表达的A549细胞的增殖率(图2B)。结果表明,FEN1的下调抑制了细胞生长(图2C),而FEN1的过表达促进了细胞生长(图2D)。集落形成实验表明,过表达FEN1诱导了A549细胞的集落形成(图2E-F),而内源性FEN1的下调则降低了A549细胞的集落形成效率(图2G)。此外,流式细胞分析显示,与对照细胞相比,FEN1基因敲除导致S期和G2/M期比例降低,G1期比例增加。将异位FEN1过表达的细胞移植到裸鼠皮下后,其肿瘤体积明显大于亲本A549细胞(图2H)。这些结果表明,FEN1促进了肿瘤在体内和体外的进展。
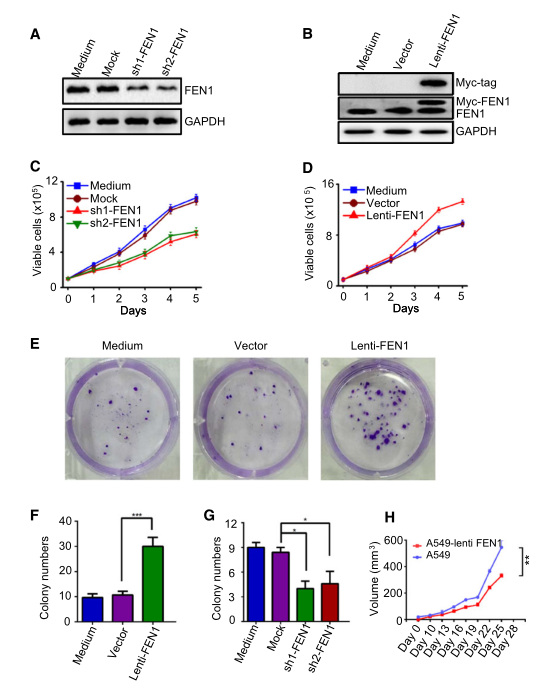
图2
3. FEN1在A549细胞顺铂耐药中的作用
鉴于FEN1在多个修复过程中的作用,例如BER、非同源末端连接、HR、NER和错配修复等,推测FEN1在肿瘤中的高水平表达与固有或获得性耐药有关。为了验证这一假设,研究者在不同FEN1水平的A549肺癌细胞中进行了药物敏感性实验。结果表明,FEN1的过表达对顺铂具有保护作用(图3A),同时,FEN1基因敲除使A549细胞对顺铂敏感(图3B)。为了进一步分析FEN1对细胞凋亡的影响,研究者测定了顺铂处理后的亚G1期细胞比例。结果表明,在顺铂作用下,FEN1基因的敲除导致亚G1期细胞积聚(图3C)。FEN1的过表达减少了顺铂诱导的亚G1期片段的产生(图3D)。TUNEL染色显示,FEN1基因敲除细胞在顺铂处理后比对照细胞凋亡更多(图3E,F),而FEN1过表达细胞凋亡比对照细胞更少(图3G,H)。这些数据表明FEN1对顺铂诱导的细胞凋亡具有保护作用。
研究者开发耐药细胞,并设计实验来评估克服顺铂耐药性的可能性。研究者将从A549肺癌细胞中建立的顺铂耐药细胞命名为A549-顺铂-R细胞或简称为A549-R。使用10和20微升的FEN1抑制剂C20处理A549-R细胞3天。结果显示,A549-R细胞对顺铂的耐药性部分丧失。
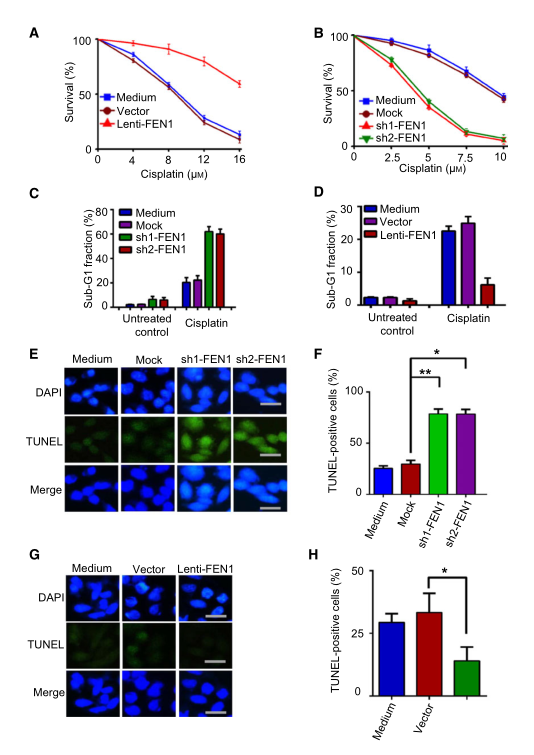
图3
4. FEN1表达对顺铂诱导的A549细胞DNA损伤修复的影响
顺铂所致损伤的修复缺陷可导致未修复的DNA中间体和DNA双链断裂(DSB)的积聚。因此,研究者预测FEN1下调的细胞将比对照细胞表现出更高水平的DNA双链断裂。为了验证假设,研究者确定了细胞中DNA双链断裂的标志物cH2AX和53BP1的病灶。的确,FEN1的下调导致了cH2AX(图4A,B)和53BP1(图4E,F)在细胞中的积累。相反,FEN1过表达降低了顺铂诱导细胞内cH2AX(图4C,D)和53BP1(图4G,H)的病灶形成水平。顺铂引起的未修复DNA损伤的积累将导致染色体断裂。为了测试FEN1对顺铂诱导的染色体断裂的影响,研究者分析了中期细胞核的染色体畸变。与对照亲本细胞相比,FEN1缺陷细胞的染色体片段和断裂水平显著增加(图4I-J)。然而,高FEN1表达水平的细胞显示染色体断裂水平降低(图4K)。
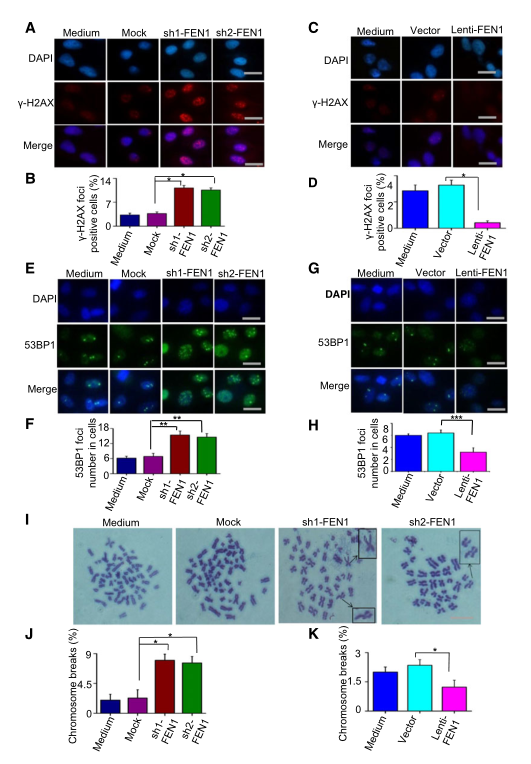
图4
5. FEN1抑制剂导致未修复的DSB积聚并增强对顺铂的敏感性
基于以上结果,研究者推测FEN1特异性抑制剂可以作为一种抗癌药物,既可以单独使用来抑制癌细胞的生长,也可以与DNA损伤诱导剂联合使用来提高治疗效果。研究者使用一种FEN1抑制剂C20验证假设,为了确定靶向抑制FEN1能否增强顺铂在A549细胞中的活性,用C20预处理A549细胞,然后用不同浓度的顺铂处理48h,图5A显示C20处理的细胞存活率显著降低。与仅用顺铂处理的细胞相比,C20和顺铂处理的细胞显示出更多的cH2AX和53BP1病灶(图5B-E)。为了评价FEN1抑制剂对不同FEN1水平细胞的毒性,研究者还比较了C20在不同肺癌细胞系中的IC50。结果显示A549、H1299和H460细胞增殖呈剂量依赖性下降,IC50分别为12.5、22.1和20.81M(图5F)。值得注意的是,FEN1表达水平低的细胞对FEN1抑制剂的敏感性较低。提示FEN1在不同癌细胞中的表达可能与其对FEN1抑制剂的敏感性有关。
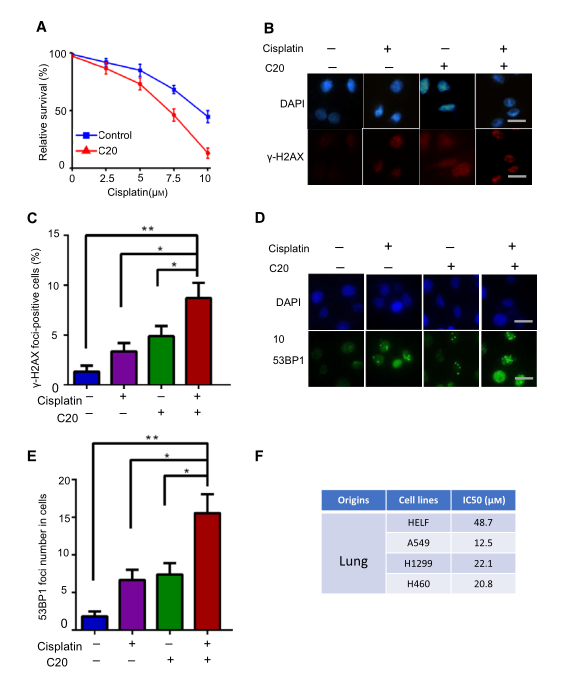
图5
6. 抑制FEN1对移植瘤小鼠的抗肿瘤作用
为了进一步研究抑制FEN1对体内肿瘤进展的影响,研究者用裸鼠进行了异种移植研究。结果显示,对照组小鼠肿瘤体积以时间依赖的方式逐渐增大。单独使用顺铂或FEN1抑制剂治疗后,移植瘤的生长略有下降(图6A)。当顺铂与FEN1抑制剂联合应用时,肿瘤生长明显减少。同时,联合治疗组动物存活率也有所提高(图6B)。这些结果表明,抑制FEN1可以增强顺铂对小鼠肺癌移植瘤的疗效。
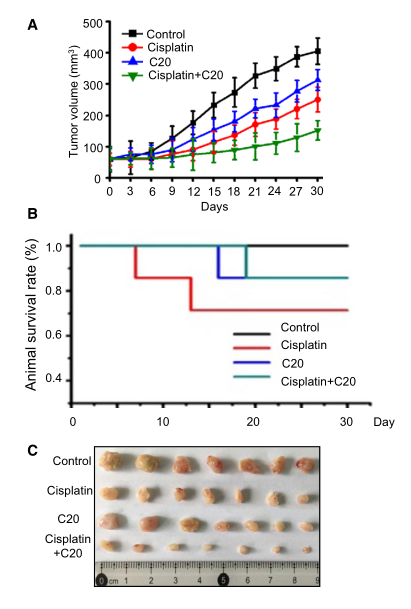
图6
7. FEN1的下调或抑制激活了细胞凋亡的内在途径
P53通路是最常见的细胞凋亡机制。在应激状态下,p53被磷酸化后激活,并作为转录因子激活凋亡相关基因的表达。研究者检测了FEN1缺乏诱导的细胞凋亡是否依赖于p53,发现顺铂(图7A)诱导P53和磷酸化的P53,表明其激活了P53通路。作为p53激活的下游事件,A549细胞中的凋亡指标caspase-3也在顺铂作用下上调。此外,c-H2AX显示DNA损伤程度与凋亡指标上调相关,顺铂可上调DNA损伤程度(图7A)。
为了明确DNA损伤是否可以诱导凋亡反应,研究者用FEN1 siRNA处理A549细胞,并检测了A549细胞的凋亡反应。结果显示,FEN1基因敲除增加了FC-H2AX的水平。同时,FEN1基因敲除后,磷酸化的p53和caspase-3的表达也被上调,这与顺铂处理结果类似(图7B)。这些数据表明,DNA损伤是由FEN1基因敲除引起的,并可能诱导p53依赖的细胞凋亡。为了进一步证实FEN1和DNA损伤水平在顺铂诱导的细胞凋亡中的作用,研究者测定了FEN1过表达的A549细胞对顺铂的反应。如图7C所示,FEN1的过表达减少了顺铂诱导的DNA损伤,顺铂诱导的p53活化和caspase-3形成也明显减少。这一结果表明,FEN1通过减少细胞内DNA损伤来保护细胞免受顺铂诱导的凋亡。
接下来,研究者对图6C中的肿瘤进行了免疫组化检测。结果如图7D所示,与caspase-3和TUNEL阳性细胞处理相比,顺铂和FEN1抑制剂联合使用对细胞凋亡显示出更大的协同作用。此外,c-H2AX和53BP1染色表明,与FEN1抑制剂或顺铂单独治疗相比,FEN1抑制剂和顺铂联合治疗可在肿瘤中产生更多的DSB,这与先前的研究结果一致。综上所述,上述结果提示FEN1下调或抑制激活了p53介导的内在凋亡途径。
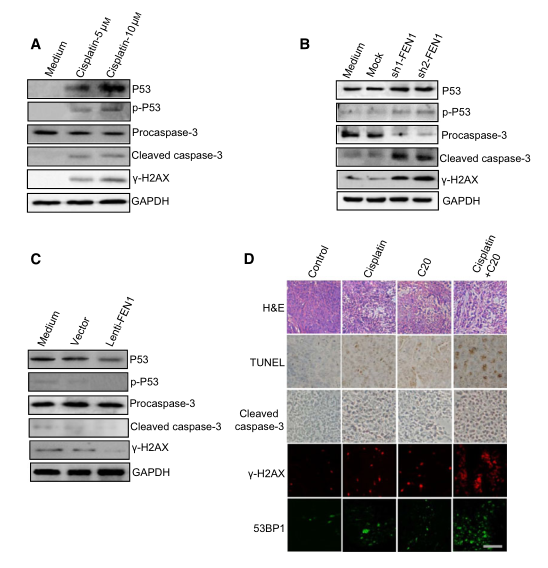
图7









 实验热线:4006991663
实验热线:4006991663









