乙型肝炎病毒激活癌胎基因SALL4在PD-L1诱导的T细胞耗竭中抵消miR-200c
发表期刊:Nature Communication
影响因子:17.694
发表时间:2018年9月
合作单位:中国科学院先天免疫与慢性病重点实验室
运用技术:shRNA慢病毒载体构建(由辉骏生物提供技术支持)
● 研究背景
慢病毒感染和肿瘤微环境可促使浸润的病毒特异性或肿瘤特异性T细胞衰竭,从而严重损害这些细胞的增殖能力和效应功能,使免疫反应无法消除病毒或排斥肿瘤。其中,肝脏病毒感染是促进肝细胞癌(HCC)发展和进展的主要因素。据报道,大多数HCC病例是HBV或丙型肝炎病毒持续感染的结果。CD8+T细胞的激活不仅通过识别感染肝细胞表面呈现的表位来调节,还通过T细胞表面的共抑制和共刺激分子、包括肝细胞在内的抗原呈递细胞(APC)上的配体相互作用介导的正负信号之间的平衡来调节。临床资料表明,PD-1/PD-L1的表达与肝癌患者的肿瘤大小、血管浸润和肿瘤分期呈正相关。然而迄今为止,HBV感染如何诱导PD-L1表达,宿主因素是否控制了HBV诱导的PD-L1表达,以及潜在的相互作用机制等仍然不清楚。
MicroRNAs(MiRNA)通过指导mRNA翻译的降解或抑制,在转录后调控靶基因,导致蛋白质水平的降低。其被认为是HBV相关HCC预后的潜在生物标志物,miR141和miR-200家族在HCC胆管肿瘤血栓患者中下调,并作为无病生存的独立预测因子。然而,MiRNA是否参与了PD-L1表达的调节,HBV是否与MiRNA有内在的抵消,以及它们之间的相互作用如何影响抗HBV免疫,都还需要进一步研究。Sal样蛋白4 (Sall4)是一种锌指转录因子,调节胚胎干细胞的多能性和自我更新14,15。SALL4作为一种在许多人类癌症中表达的重要转录因子,其高表达与侵袭性HCC和不良预后相关。然而,HBV是否具有激活成人肝脏中SALL4表达的功能,以及SALL4和miRNA是否相互作用以调节PD-L1的表达仍不清楚。
● 研究结果
1.肝癌组织中SALL4和PD-L1与miR-200c呈负相关
科学界已经认识到PD-L1在多种恶性肿瘤中的作用,在微阵列分析中,miR-200c被报道为HCC的miRNA指示物之一,SALL4在HCC中高表达且预后不良。分析显示,miR-200c直接靶向PD-L1的3‘-UTR;另一方面,转录因子SALL家族调控miR-200c在miR-200c启动子区域内的三个可能的结合位点的表达(图1A)。免疫组织化学分析(图1B)结果显示98例肝癌患者肿瘤组织中PD-L1和SALL4在瘤周和瘤中心的表达,发现癌中心区SALL4和PD-L1的表达均显著增高(图1C,D)。原位杂交显示肿瘤中心miR-200c的表达密度显著高于瘤周(图1E)。值得注意的是,虽然SALL4、PD-L1和miR200c的表达均有显著增加,但这三个分子的差异极大,与肿瘤中心区域相比,SALL4和PD-L1的表达明显升高,而miR-200c的表达相对较低,而SALL4和PD-L1的表达是平行的(图1F),提示在HCC进展过程中SALL4、miR-200c和PD-L1之间可能存在密切的关系。
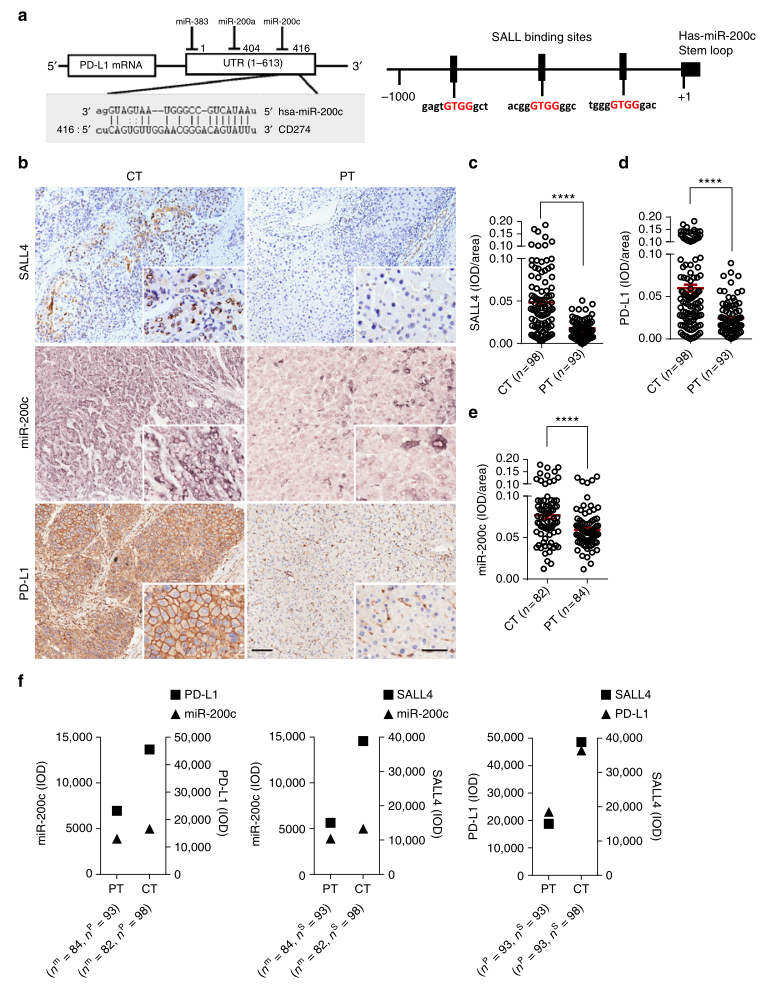
图1
研究者分析了每个HCC患者肿瘤中心区域SALL4、miR-200c和PD-L1表达之间的关系,在3例有代表性的患者中,miR-200c的低表达明显伴随着SALL4或PD-L1的高密度,而miR-200c的高表达使SALL4或PD-L1的密度保持较低(图2A),导致SALL4和miR-200c或miR-200c和PD-L1之间存在高度显著的两对负相关,同时SALL4和PD-L1表达之间存在正相关(图2B);而在瘤周区域,这些分子之间不具有统计相关性(图2C,D)。接下来,研究者利用QRT-PCR技术检测了8例新鲜肝癌组织中miR-200c的表达,结果显示miR-200c的表达与SALL4或PD-L1的积分光密度(IOD)/面积呈负相关(图2E)。研究者进一步检测了可能靶向PD-L1的miR-200A和miR-383的表达,并分析了它们与肝癌患者SALL4和PD-L1表达的关系,结果证实了miR-200c与SALL4或PD-L1相互作用的特异性。

图2
2. SALL4和miR-200c与总生存期相关
研究者对SALL4和miR-200c在肿瘤中心区域的潜在预后价值进行了评估。统计学分析显示,PD-L1(积分光密度/面积)与肿瘤中心的总生存率(OS)呈负相关(图3A),而在瘤周无相关性(图3B);肿瘤中心区域PD-L1的高表达与肝癌患者较短的OS显著相关(图3C)。在同一HCC组中,miR-200c的表达与OS在肿瘤中心和瘤周中也存在正相关(图3D,E),且miR-200c密度越高,OS预后越好(图3F)。此外,与PD-L1相似,肿瘤中心区域SALL4的表达与OS呈负相关(图3G),而与瘤周区域无相关性(图3H),表明肿瘤中心区域SALL4高表达的患者OS较短(图3I)。此外,综合分析显示,SALL4降低而miR-200c升高(图3J)、SALL4降低而PD-L1降低(图3K)、PD-L1降低而miR-200c升高(图3L)的患者的OS显著延长。这些发现证明了SALL4或miR-200c在肿瘤中心区域的预后价值,可能成为一项有前途的肝癌生存预测指标。
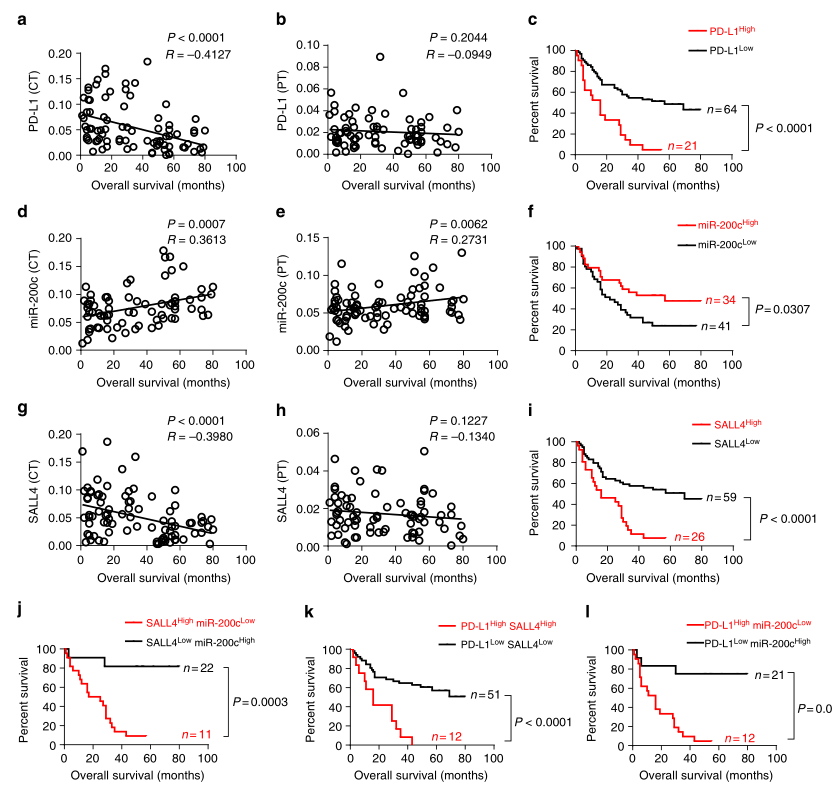
图3
3. miR-200c下调HBV诱导的PD-L1表达
HBV慢性感染是肝癌发生的关键因素,为研究其潜在机制,研究者检测了HBV +HLCZ01细胞中转染miR-200c、miR-200a和miR-383的模拟物或抑制剂后PD-L1的表达,这些模拟物或抑制剂在HBV+HLCZ01细胞中均减少,并且有可能靶向PD-L1的3ʹ-UTR(图1A)。miR-200c模拟物显著降低PD-L1表达,miR-200c抑制剂显著增强PD-L1表达,而miR-200a和miR-383模拟物则对PD-L1水平无显著影响(图4A)。miR-200c模拟物和抑制剂对PD-L1表达的影响是剂量依赖性的(图4B)。为了进一步证实miR-200c直接靶向PD-L1的3ʹ-UTR,研究者进行了荧光素酶报告实验。结果显示,miR-200c模拟物显著降低荧光素酶活性,而miR-200c抑制剂显著增强荧光素酶活性。这些结果表明,miR-200c直接靶向PD-L1的3ʹ-UTR。
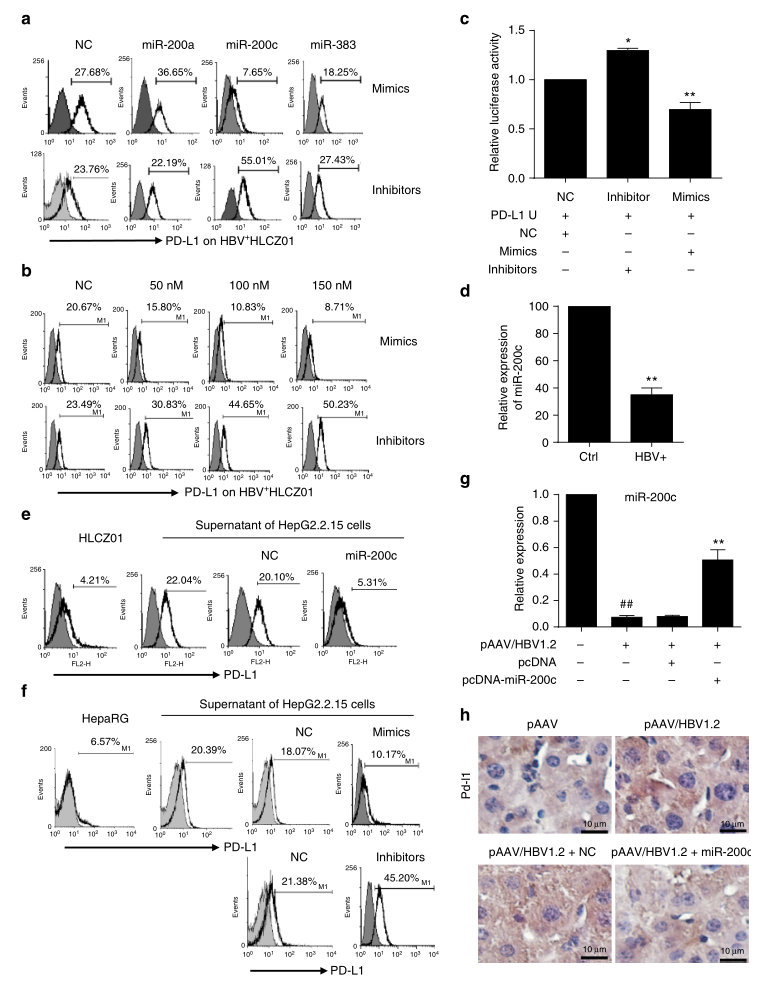
图4
为了探讨miR-200c是否能拮抗HBV,从而影响PD-L1的表达,研究者用HBV感染细胞,并检测miR-200c的相对表达,结果显示细胞中miR-200c的表达受到显著抑制(图4D),表明HBV抑制了miR-200c的表达。研究者还将miR-200c模拟物转染到HBV +HLCZ01细胞中,发现miR-200c几乎完全消除了HBV介导的PD-L1表达上调(图4E),表明miR-200c阻碍HBV介导的PD-L1表达。使用HepaRG细胞系的另一个体外HBV感染模型也获得了类似的结果(图4F)。研究者构建了一个miR-200c过表达载体,将其注射到HBV持续感染的小鼠体内。正如预期的那样,HBV +小鼠中的miR-200c表达水平显著低于HBV -小鼠(图4G)。相反,miR-200c过表达显著减弱HBV诱导的肝细胞PD-L1表达上调(图4H)。这些结果表明,HBV和miR-200c在HBV感染的肝细胞内PD-L1表达过程中存在拮抗作用。
4. miR-200c逆转HBV阳性小鼠CD8+T细胞耗竭
肝细胞中PD-L1的升高导致了HBV持续感染小鼠中CD8+T细胞的耗竭。研究者进一步探讨了miR-200c在HBV诱导的CD8+T细胞耗竭中的作用,结果显示,在小鼠肝脏特异性miR-200c过表达后,小鼠肝脏CD69+CD8+、干扰素-γ+CD8+和CD107a+CD8+T细胞的百分比和对靶细胞的杀伤作用显著增加,接近了PD-L1阻断所达到的水平(图5A-G)。miR-200c过表达小鼠的肝淋巴细胞含有更多的HBc特异性CD8+T细胞(图5I)、HBc特异性干扰素-γ+CD8+T细胞(图5J)和HBc特异性记忆CD8+T细胞(图5K),表明miR-200c过表达的小鼠肝淋巴细胞含有更多的HBc特异性CD8+T细胞(图5I),特别是更多的HBc特异性干扰素-CD8+CD8+T细胞(图5J)和更多的HBc特异性记忆CD8+T细胞。

图5
5. HBV通过STAT3诱导SALL4下调miR-200c
通过比较HBV +和HBV -肝癌细胞中STAT3的磷酸化水平,研究者发现HBV促进了STAT3的激活(图6A)。进一步做DNA序列分析,-1.5-kb SALL4启动子区域显示了四个与STAT3结合的共同序列(图6B)。用STAT3抑制剂WP1006处理HBV诱导的HLCZ01和HepaRG细胞,然后检测SALL4蛋白的表达,结果显示STAT3抑制剂WP1006显著降低了HBV诱导的两种细胞中SALL4的表达(图6C)。为了证实STAT3在SALL4表达调控中的作用,研究者构建了含有SALL4启动子或突变启动子的荧光素酶报告载体。用报告载体转染HLCZ01细胞,同时用STAT3激活的细胞因子IL-6处理HLCZ01细胞,结果显示,IL-6刺激可显著增强SALL4野生型启动子的活性,而不是突变启动子的活性,这可能是通过激活STAT3来实现的,因为WP1006抑制STAT3的激活会显著降低SALL4启动子的荧光素酶活性(图6D)。通过染色质免疫沉淀(ChIP)技术,研究者还发现内源性STAT3可以直接与SALL4的启动子区域结合(图6E),表明HBV的持续可能通过STAT3诱导的转录抑制因子SALL4下调miR-200c。正如预期的那样,WP1006处理显著降低了HBV+HLCZ01细胞在基因和蛋白水平上PD-L1的表达(图6F-G)。
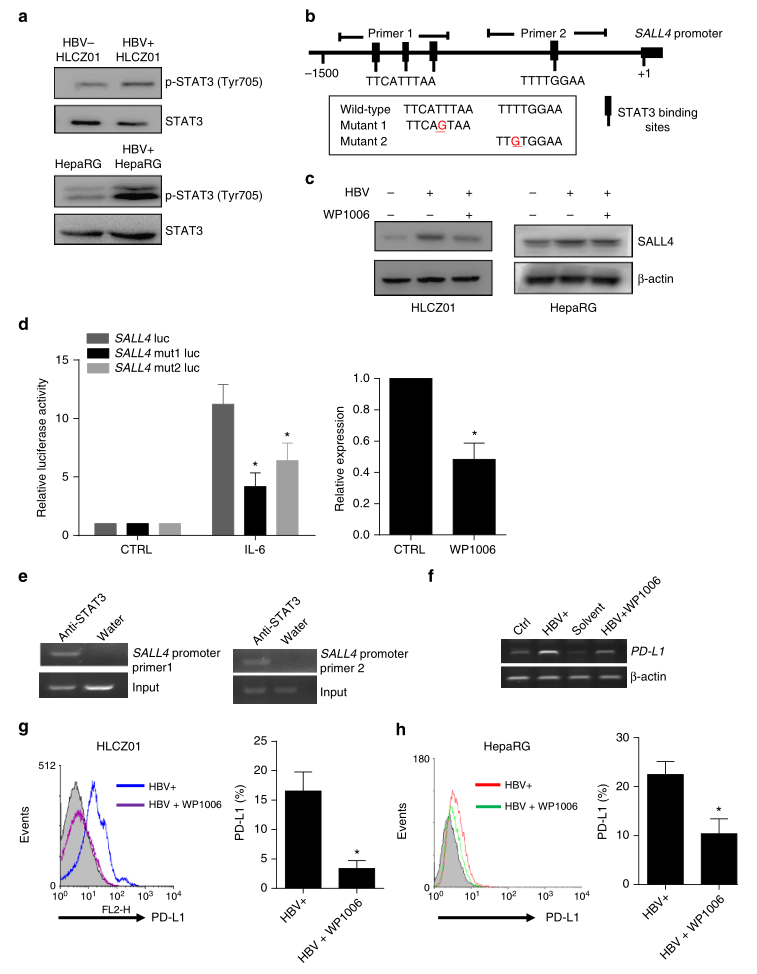
图6
接下来,研究者试图研究SALL4是如何调控miR-200c转录的。生物信息学分析显示,miR-200c的启动子区域内有三个推测的SALL家族结合位点(图1A)。HBV感染显著促进了HLCZ01细胞SALL家族,尤其是SALL4在mRNA(上调)和蛋白(下调)水平的表达(图7A)。进一步分析显示,沉默SALL4显著增强miR-200c的表达,并导致HBV诱导的PD-L1表达降低,而SALL4的过表达显著降低miR-200c的转录,增强PD-L1的表达(图7D,E),HBV+HepaRG细胞中的结果也是类似的(图7F-H)。后续的荧光素酶报告和ChIP实验进一步证实,SALL4抑制了miR-200c的启动子活性(图7I),并能直接与miR-200c的启动子区域结合(图7J)。这些结果清楚地表明,HBV的持续促进了转录抑制因子SALL4的表达,SALL4又通过与启动子区域结合直接抑制miR-200c的表达。
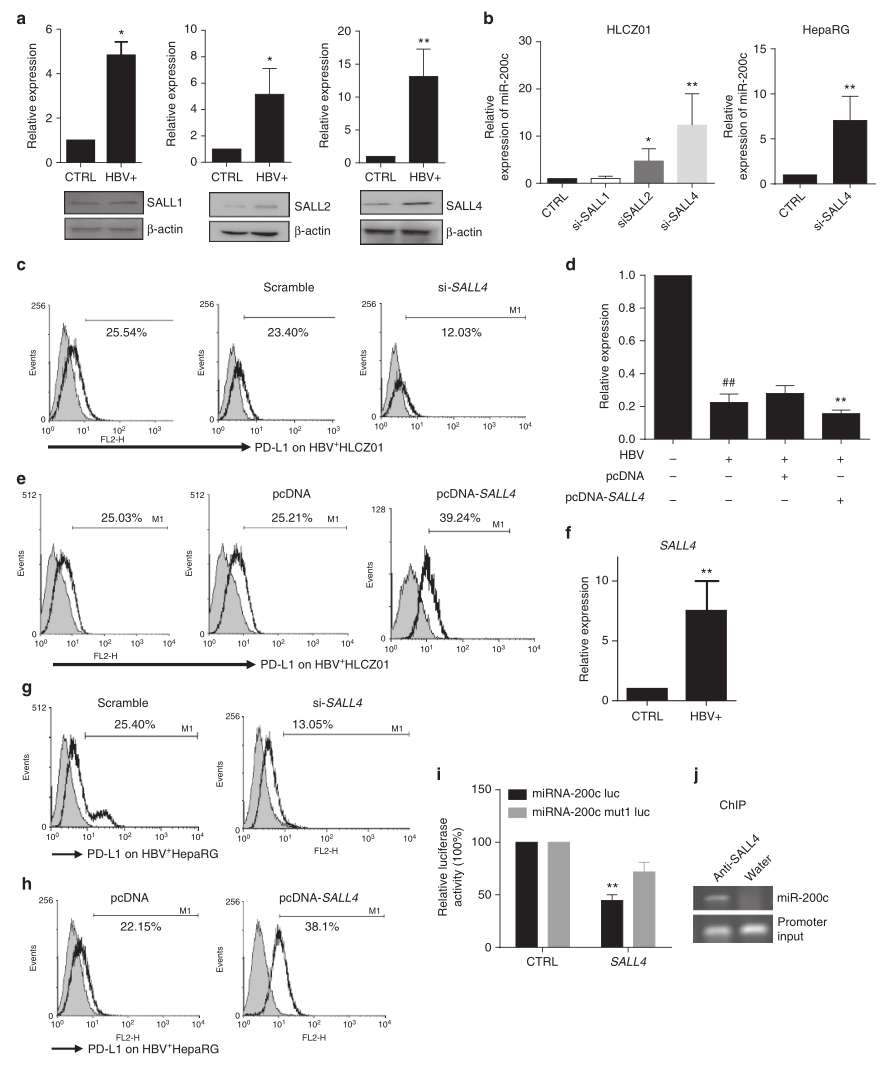
图7
6. 沉默Sall4阻碍HBV复制和CTL耗尽
为了进一步证实SALL4在体内促进HBV持续存在和HCC进展中的作用,研究者沉默SALL4基因,以观察其对HBV持续存在小鼠中HBV感染或持续的影响(图8A,B)。与HBV−小鼠相比,持续感染HBV的小鼠SALL4和PD-L1的表达较高,miR-200c的转录较低,而沉默SALL4则显著增强miR-200c的转录并降低PD-L1的表达(图8C,D)。此外,沉默Sall4显著增加干扰素-γ+CD8+T细胞的百分比,降低CD8+T细胞上PD-1的表达,抑制CD8+T细胞的凋亡(图8E),同时降低乙肝病毒持续存在小鼠的HBsAg和HBeAg水平(图8F)。
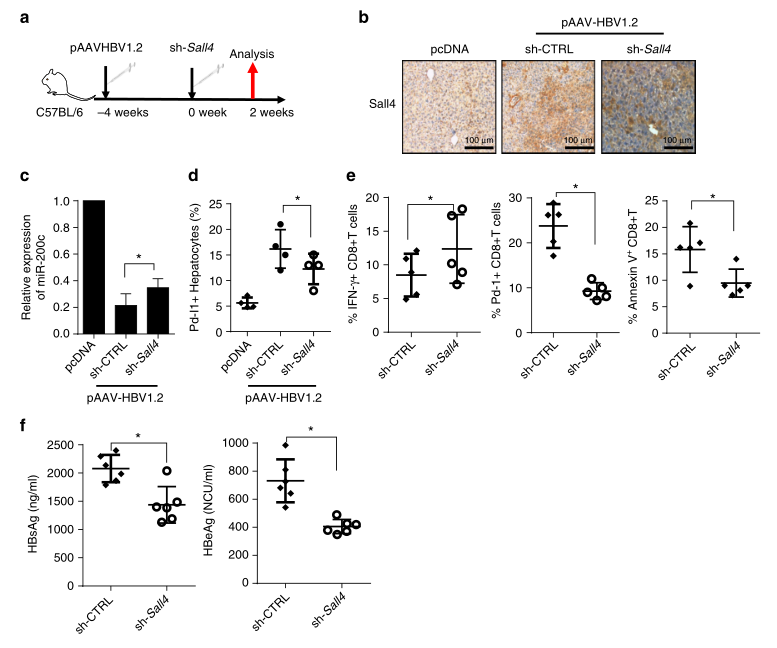
图8
研究进一步证实,在HBV+HCC患者中,肝癌细胞中SALL4的重新激活与CD8+T细胞耗竭有关。研究者采用免疫荧光染色法检测新鲜肝癌患者瘤周和瘤中心的SALL4表达、PD-1表达和CD8+T细胞浸润情况,结果显示,SALL4在肿瘤中心区域的表达明显高于瘤周区域,SALL4在中心肿瘤区域的表达远高于肿瘤周围区域,而肿瘤中心区域的肿瘤浸润性CD8+T细胞含量远低于肿瘤周围区域(图9A);不过尽管肿瘤中心区域的肿瘤浸润性CD8+T细胞总数量减少,中心肿瘤区域的PD-1+CD8+T细胞含量是远高于瘤周区域的(图9A)。此外,统计分析表明,SALL4表达与肿瘤浸润性PD-1+CD8+T细胞之间存在正相关(图9B),这增加了肝细胞SALL4在HBV+HCC进展过程中通过表达PD-L1参与PD-1+CD8+T细胞衰竭的可能性。

图9









 实验热线:4006991663
实验热线:4006991663











