中文标题:FEN1 L209P突变干扰长斑块碱基切除修复并诱导细胞转化
发表期刊:Oncogene
中科院分区:1区
影响因子:8.756
发表时间:2016年6月
合作单位:南京师范大学
运用技术:载体构建(由辉骏生物提供技术支持)
● 研究背景
基因组DNA不断暴露于内源性或外源性损伤中,从而导致DNA损伤。DNA损伤如果不修复,可能导致基因突变和随后的基因组不稳定以及癌症的发生。 DNA损伤的清除和基因组完整性的维持取决于强大的细胞DNA修复系统,而碱基切除修复是真核细胞处理内源性和外源性DNA碱基损伤的主要修复途径之一。LP-BER是修复细胞核和线粒体氧化碱基的主要途径,BER是通过特异性DNA糖基化酶切除受损碱基,然后通过AP核酸内切酶1(APE1)切割DNA骨架而启动的,这种中间结构可以通过SP-BER或LPBER途径加工。FEN1在LP-BER中起着核心作用,对维持基因组的稳定性和完整性是必不可少的。FEN1是一种结构特异的核酸酶,具有5‘翻盖内切酶(FEN)、5’-3‘外切酶(EXO)和间隙核酸内切酶(GEN)活性。在小鼠模型中,缺乏Gen和EXO活性的FEN1突变会导致肺腺瘤的高发病率,FEN1的功能缺陷与人类癌症风险增加之间也存在联系。
尽管在多种癌症中发现了许多其他DNA修复基因的体细胞突变,但FEN1突变非常罕见,这表明FEN1对正常的DNA新陈代谢很重要。近来在人结肠癌标本中发现了4个FEN1中体细胞的、非同义的、杂合性的单核苷酸替换,它们分别是:E20D、L209P、R245G和S329N。确定这些突变是否会影响FEN1的功能并促进癌症的发生和发展,这一点很重要。
● 研究结果
1. L209P变异在结肠癌中的发生
FEN1对于维持基因组DNA的稳定性和完整性很重要,研究者推测FEN1功能缺失突变可能会导致癌症的发生和发展。癌症基因组数据库检索发现,大多数癌症类型的肿瘤组织中都存在杂合的FEN1体细胞突变,33例结直肠癌患者的FEN1突变频率最高(图1A)。已在结直肠癌中检测到四个FEN1突变,分别是E20D、L209P、R245G和S329N(图1B)。研究者重点研究了L209P突变,因为它位于核心核酸酶域(图1C),并且在进化上是保守的。为了预测L209P突变对FEN1活性和DNA底物结合的影响,研究者进行了生物信息学分析。结果表明,L209P突变会导致FEN1活性丧失,但并没有明显改变FEN1/DNA的相互作用,这与观察到的其不影响DNA结合的结果一致。为了部分验证这一预测,在大肠杆菌中表达了FEN1 L209P和WT,并将其纯化为均一(图1E)。圆二色谱分析结果显示L209P FEN1蛋白在22℃时与WT FEN1蛋白的构象几乎相同(图1F),表明脯氨酸到亮氨酸的转变对蛋白质构象没有明显影响。为了研究L209P突变是否影响FEN1的热稳定性,研究者还在37°C进行了圆二色谱分析(图1G)。结果表明,L209P FEN1的整体结构与WT FEN1相似,说明FEN1的热稳定性不受L209P突变的影响。
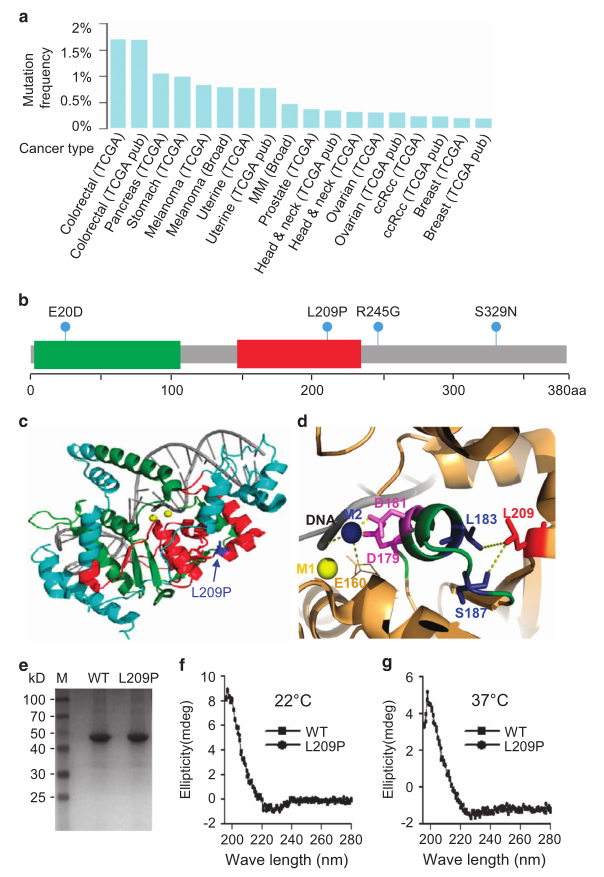
图1
2. FEN1 L209P突变体缺乏三种核酸酶活性
为了进一步验证预测和评估L209P突变对FEN1生化活性的影响,研究者使用合成的DNA底物在体外检测了L209P FEN1的FEN1的FEN、EXO和GEN活性。正如图1D所预测的那样,当在37°C测定时,L209P突变几乎完全消除了FEN1的三种活性(图2A-C)。由于L209P和WT FEN1在22°C和37°C具有相同的整体结构,因此L209P FEN1活性的缺陷不太可能是由于L209P蛋白对温度的敏感性造成的。
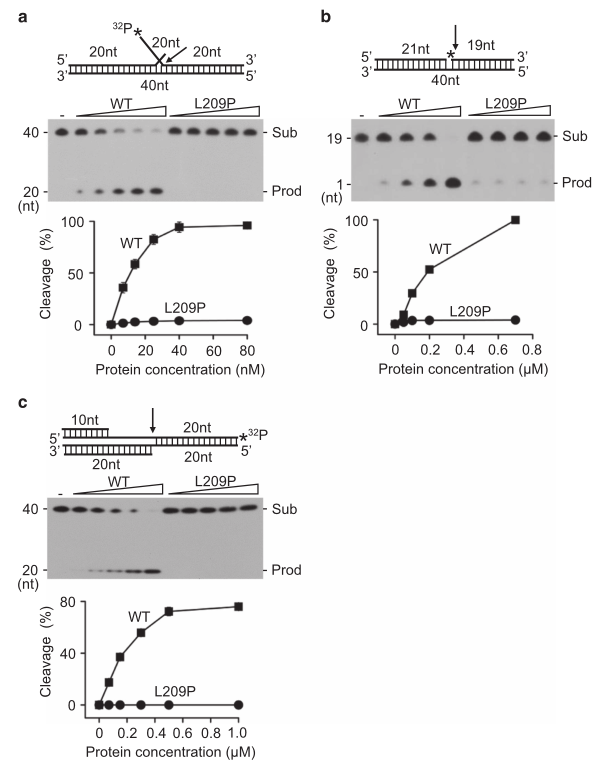
图2
3. L209P FEN1保持完整的DNA底物结合能力
由于L209P FEN1与WT FEN1具有相同的整体结构(图1f),因此全局结构缺陷不太可能是L209P FEN1活性降低的原因。研究者使用凝胶偏移(图3A、C和E)和酶联免疫吸附(ELISA)分析(图3B、D和F)来确定FEN1-DNA结合亲和力。两种检测方法均显示L209P变异体与WT FEN1的DNA结合亲和力无差异。这一结果与之前的观察结果一致,即只有带正电荷的氨基酸,如第70、245和327位的精氨酸,以及第244、252和326位的赖氨酸,才直接参与FEN1-DNA的相互作用。
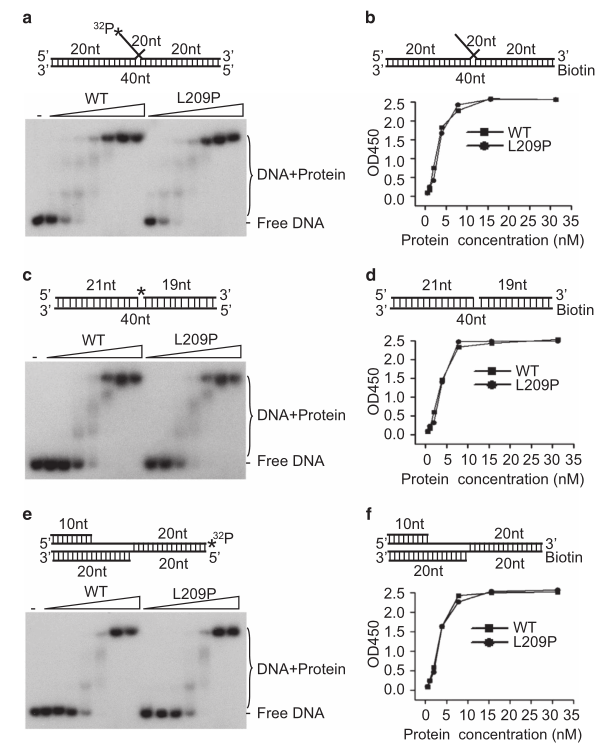
图3
4. L209P FEN1干扰WT FEN1核酸酶活性
由于L209P FEN1具有完整的DNA底物结合亲和力,研究者推测L209P FEN1的存在可能干扰了WT FEN1的活性。为了验证这一假设,研究者将不同数量的每种蛋白质与DNA底物混合,并测定了它们的FEN(图4A)、EXO(图4B)和GEN(图4C)活性。当L209P FEN1与WT FEN1共同孵育时,WT FEN1的活性被抑制。L209P FEN1对WT FEN1的抑制作用呈剂量依赖性。这些结果表明,L209P对WT FEN1的活性呈显性抑制。
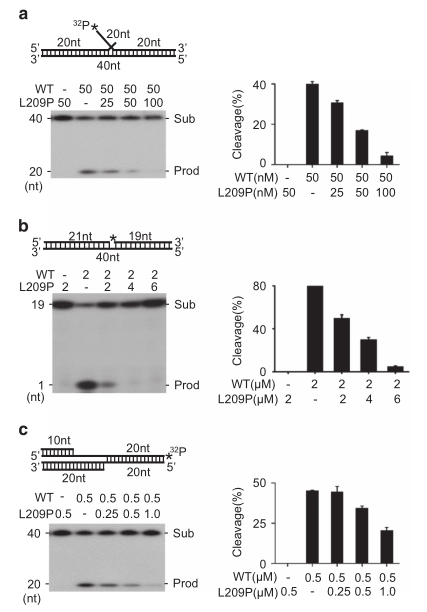
图4
5. L209P FEN1突变干扰BER效率
剥离结构的去除是完成LP-BER的关键步骤。L209P FEN1活性降低提示该突变可能影响了LP-BER功能。为了验证这一假设,研究者使用纯化的蛋白进行了LP-BER分析。结果显示在存在WT FEN1而不是L209P FEN1突变体的情况下,THF的损伤得到了有效的修复(图5A)。为了验证L209P FEN1是否干扰WT FEN1的整体BER效率,研究者将纯化的L209P FEN1与WT FEN1蛋白混合进行LP-BER分析。结果表明,在L209P FEN1蛋白存在的情况下,BER效率降低(图5B)。此外,研究者使用SW480细胞提取物(含或不含其他L209P FEN1蛋白)进行LP-BER,以确定L209P FEN1是否会在细胞提取物环境中损害BER。结果显示,虽然SW480细胞提取物可以有效修复THF损伤,但在细胞提取物中加入L209P FEN1会降BER率效率(图5C)。为了模拟在人结肠癌细胞中检测到的FEN1杂合L209P体细胞突变,研究者在也含有内源性WT FEN1的SW480细胞中过表达L209P FEN1或WT FEN1,结果表明,表达L209P FEN1的细胞提取物的BER远低于表达WT FEN1的细胞提取物(图5D)。上述数据表明,在SW480细胞中纯化或表达的L209P FEN1干扰WT FEN1的BER活性。
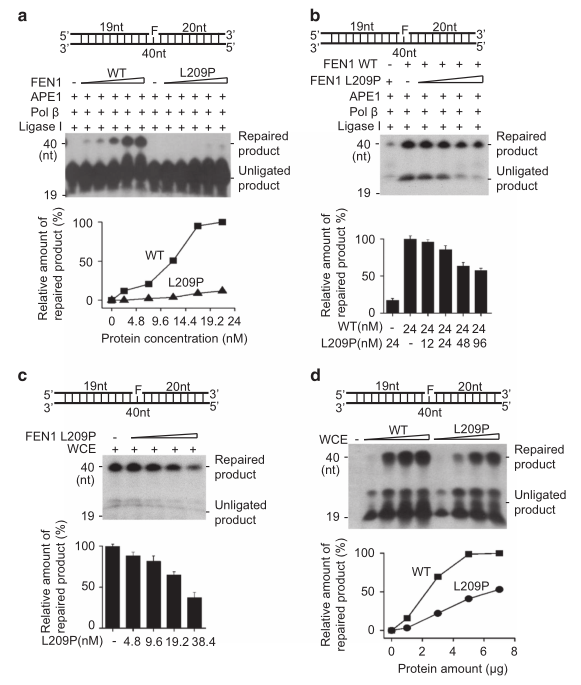
图5
6. L209P FEN1的表达增强细胞对DNA损伤的敏感性
为了研究L209P FEN1变异体在细胞中可能的生物学功能,研究者用含L209P或WT FEN1基因的慢病毒载体转染SW480结肠癌细胞。结果显示,转染L209P FEN1的细胞比转染WT FEN1或转染亲本对照SW480的细胞对5-FU或H2O2更敏感,表明含L209P FEN1的细胞LP-BER修复存在缺陷(图6A和B)。荧光激活细胞分选分析比较5-FU和H2O2诱导的细胞凋亡率,结果显示,经5-FU或H2O2处理后,表达FEN1的细胞的凋亡率明显高于表达WT FEN1或亲本SW480的细胞(图6C)。用细胞凋亡标志物Caspase-3的抗体进行细胞染色,也证实了荧光激活的细胞分选结果(图6D和E)。这些数据支持了以前的报道,即DNA损伤如果不修复,可能会导致细胞凋亡。然而,由于DNA损伤的积累和基因组的不稳定,非凋亡处理的细胞可能更容易转化。
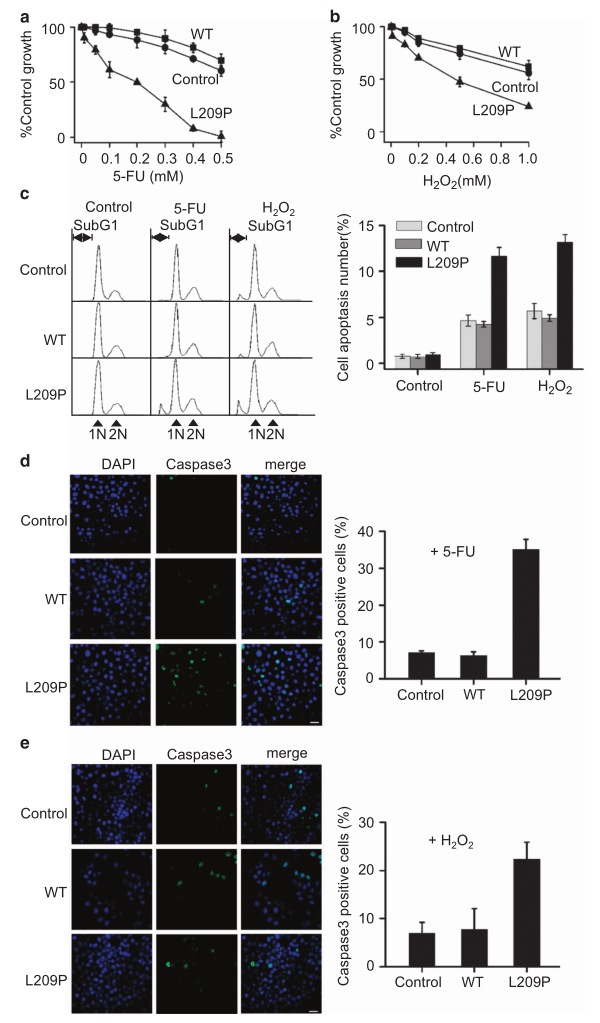
图6
7. L209P引起内源性DNA损伤和染色体畸变
除了外源性物质的损伤外,DNA损伤也可能是代谢或水解过程的自然反应。因此,研究者预计L209P细胞比WT细胞表现出更高的内源性DNA损伤水平。为了验证这一假设,研究者检测了H2AX组蛋白磷酸化形式(DNAH2AX)的水平,该蛋白是细胞对γ断裂反应的早期标志物。在没有外源性γ损伤的情况下,L209P细胞磷酸化DNAH2AX的基础水平高于WT细胞(图7A)。此外,在γH2AX抗体染色的细胞中可检测到DSB的核病灶。结果显示,含L209P FEN1细胞的γH2AX阳性核数量多于WT细胞(图7B)。结果表明,L209P FEN1的表达导致DNA双链断裂的积累。接下来,为了弄清染色体不稳定是由于DNA单链断裂(SSB)在S期转化为DNADSB,还是由其他复制缺陷引起的,研究者将细胞与抗53BP1(肿瘤抑制因子p53结合蛋白1)和CENPF(着丝粒蛋白F)的抗体共染色。53BP1是DSB修复的关键调节因子,53BP1病灶的形成提示DNA复制效率低下/有缺陷。结果显示,在没有外源性DNA损伤来源的情况下,G2中53BP1焦点显著增加(图7C),表明自发损伤是由未修复的SSB碰撞引起的。然而在G1(CENPF阴性细胞)中也观察到53BP1病灶的增加(图7D),表明L209P FEN1也会导致DNA复制缺陷。
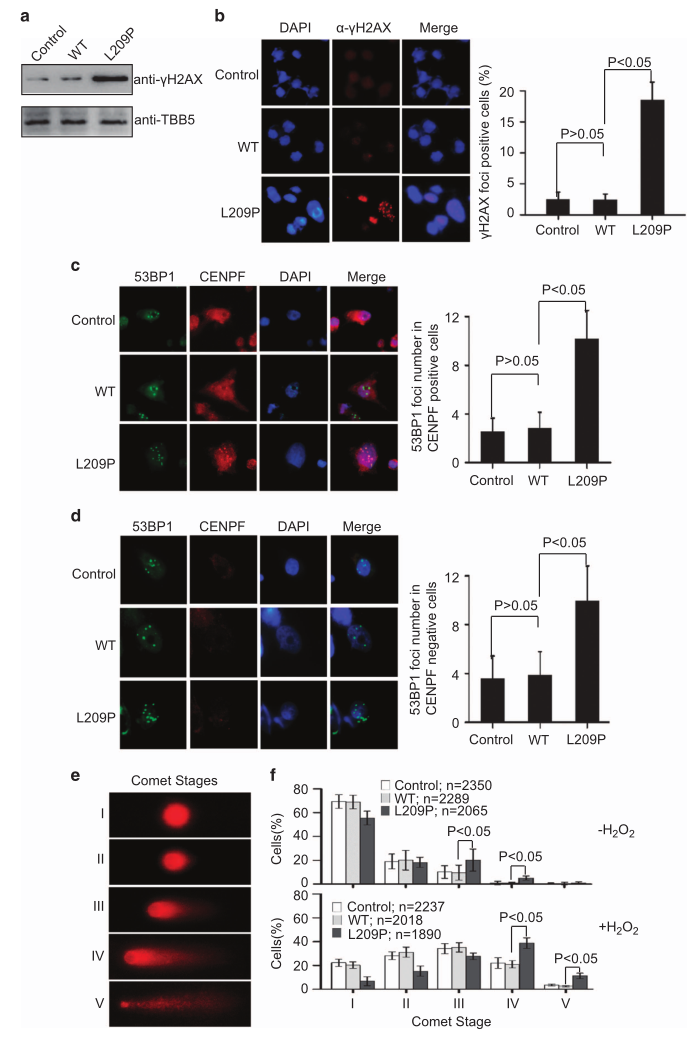
图7
为了检测Lp-BER在体内表达L209P的细胞中是否受到抑制,研究者进行了碱性彗星试验,评估了彗星事件在确定的DNA碎裂阶段的总体分布(图7E)。这些阶段包括没有DNA断裂的细胞(阶段I)到DNA严重断裂的细胞(阶段V)。不经H2O2处理的SW480细胞显示,表达L209P FEN1的SW480细胞的自发DNA链断裂水平相对高于WT细胞(阶段III和IV,图7F)。H2O2处理后,所有细胞系均显示出严重的DNA损伤(图7F)。而表达L209P FEN1的细胞显示出比表达WT FEN1的细胞更强的DNA损伤。对彗星阶段分布的研究证实,L209P FEN1突变导致了LP-BER的缺陷,以及Okazaki片段的成熟。
BER缺陷会导致BER中间体的显著积累(图7A-D),这将导致染色体畸变。为了测试表达L209P FEN1的细胞是否比表达WT FEN1的细胞和亲本SW480对照细胞积累了更多的染色体断裂,研究者分析了中期细胞核的染色体畸变,结果显示与表达WT FEN1的亲本细胞和对照亲本细胞相比,表达L209P FEN1的细胞染色体片段和断裂水平显著增加(图8A)。这一结果表明L209P FEN1的表达确实导致了细胞基因组的不稳定。
8. L209P诱导细胞转化
有报道称非整倍体是癌细胞的标志,因此研究者首先测定了表达FEN1的WT细胞和突变型L209P FEN1细胞的非整倍体率。结果显示表达L209P FEN1的细胞的非整倍体率几乎是表达WT FEN1的细胞的4倍(图8B)。这表明,表达L209P FEN1的细胞自发积累染色体片段,导致染色体不稳定和非整倍体的出现。这些细胞异常可能促进细胞转化并导致克隆性扩张。为了确定L209P突变是否促进肿瘤的发生,研究者进行了病灶形成和软琼脂锚定非依赖性生长试验,结果表明L209P FEN1细胞比WT FEN1细胞含有更多的转化细胞。研究者进一步将表达L209P FEN1的细胞、表达WT FEN1的细胞和双亲对照的SW480细胞注射到成年免疫缺陷小鼠体内,结果显示表达L209P FEN1的肿瘤的生长速率显著高于WT FEN1和亲代对照组的生长速率(图8C)。肿瘤称重显示,表达L209P FEN1的细胞的平均肿瘤重量显著高于表达WT FEN1的细胞和亲本对照细胞的肿瘤重量(图8D)。这些数据表明,携带L209P FEN1突变的细胞比WT细胞更具致瘤性。
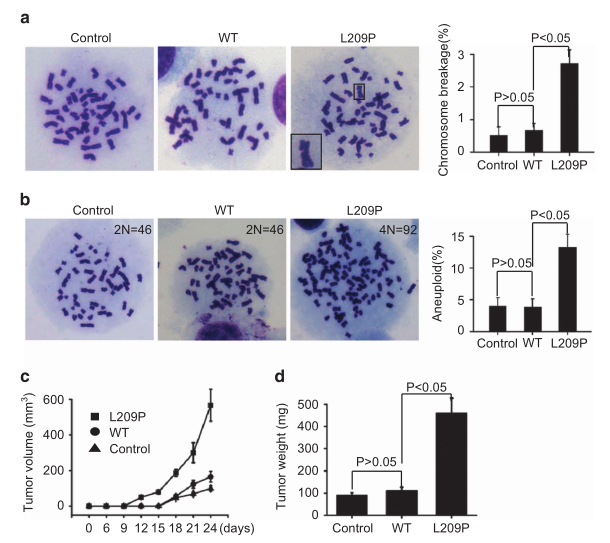
图8









 实验热线:4006991663
实验热线:4006991663










