RNA结合蛋白(RNA binding protein,RBP)是一类功能强大而广泛的调节因子,约占细胞编码的所有蛋白的5%~10%。目前除了少数RNA以核酶形式单独发挥功能,大部分RNA通过与蛋白结合形成RNA-蛋白复合物来发挥作用。
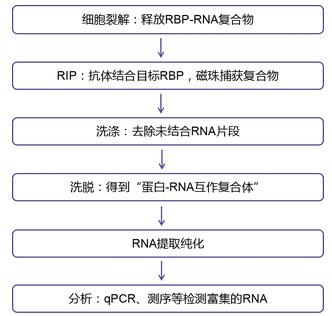
RIP(RNA Binding Protein Immunoprecipitation,RNA结合蛋白免疫沉淀)是在传统IP实验基础上衍生出的应用,核心用于研究体内RNA与蛋白的结合情况。其原理是基于抗体特异性识别目标蛋白,从而将与蛋白结合的RNA复合物沉淀下来。
目前,RIP技术主要有两大方向:一是明确特定蛋白与RNA之间的结合对应关系;二是结合高通量测序技术,筛选出RBP所调控靶基因。
样本裂解液与结合了抗体的磁珠或树脂(Beads)进行孵育,通过”抗原-抗体“之间的免疫作用,将“抗体-诱饵蛋白-互作RNA”一起“共沉淀”到Beads上。
洗掉未结合的RNA后,再将“诱饵蛋白-互作RNA”从Beads洗脱下来,提取洗脱液中的RNA,之后可以用qPCR检测已知RNA,也可以用二代测序检测未知RNA。
图1 RIP实验原理图
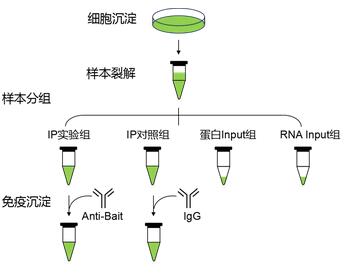
RIP实验大致流程:样本裂解→Input样品制备→样本裂解液与抗体孵育(抗原抗体结合)→proteinA/G磁珠与抗体结合→RNA免疫共沉淀(RIP)→复合物洗脱→RNA提取→qPCR或测序分析
1 细胞收集
(1)每组细胞收集1-2*10e7个,弃培养基;
(2)用预冷的PBS清洗细胞2-3次,彻底去除培养基成分;
2 细胞裂解
(1)加入0.6-1mL预冷的裂解缓冲液(辉骏货号:FI8101),在裂解液中预先加入6-10μL蛋白酶抑制剂(辉骏货号:FI8105)、3-5μL RNA酶抑制剂(辉骏货号:FI8106),现用现配;
(2)为了更充分裂解,最好冰上超声至溶液基本澄清;如果无超声条件,可置于冰上裂解30min,期间每10 min涡旋混匀一次,每次5s;
(3)4℃ 12000 rpm离心15 min,收集上清至新的无RNase的1.5 mL EP管中。
3 Input样本制备
(1)取30 μL作为蛋白 input,取30 μL作为RNA input;
(2)剩余上清平分为两份用于RIP实验(记为实验组和对照组),置于冰上备用或-80℃保存。
(1)涡旋混匀proteinA/G磁珠(辉骏货号:FI8302),按照每组40 μL的用量取出混匀好的磁珠;(2)每组加入200 µL漂洗液(辉骏货号:FI8107),颠倒混匀30次,放磁力架上静置1 min ,并弃上清;
(3)重复上步操作一次。
5 样本裂解液与抗体孵育
(1)向样本裂解液中加入诱饵蛋白抗体或Normal IgG,放混匀仪上室温孵育1-2 h(或4℃过夜孵育以提高灵敏度);
(2)洗涤2次去除未结合抗体(使用漂洗缓冲液)。
6 protein A/G磁珠与抗体结合
(1)向protein A/G磁珠中加入的样本-抗体混合物,放混匀仪上4℃孵育2 h;
(2)放磁力架上静置 1 min 并弃上清;
(3)每组加入500 μL漂洗液,颠倒混匀30次,放磁力架上静置1 min,后弃上清;
(4)重复上步操作一次;
(5)再次加入500 μL漂洗液,颠倒混匀30次;
(6)取100 μL移入新离心管中用于蛋白检测(标注为管1),剩余400 μL用于RNA提取(标注为管2),两管分别放磁力架上静置1 min 并弃上清,保留磁珠。
7 蛋白Input和诱饵蛋白检测
(1)向蛋白Input组、管1的磁珠中加入1×SDS-PAGE上样缓冲液,95℃加热5-10 min;
(2)管1放磁力架上静置1 min,收集上清至新的离心管中,Western Blot检测诱饵蛋白的表达情况,验证是否IP成功。
8 RNA提取纯化
方案1——试剂盒提取RNA,可按照微量RNA提取试剂盒来提取RNA。
方案2——Trizol法提取RNA
(1)向管2的磁珠中加入1 mL Trizol,室温静置5 min;4℃ 12000 g 离心10 min,取上清;
(2)加入0.2 mL氯仿,涡旋混匀或猛烈晃动15 s,室温放置2~3 min;
(3)4℃ 12000 g离心15 min,吸取水相至新的无RNase1.5 mL EP管中(约可吸取0.5-0.55 mL);
(4)加入0.5 mL异丙醇,颠倒数次混匀,室温下沉淀10 min或-20℃沉淀过夜;
(5)4℃ 12000 g离心 10 min,管底可见RNA沉淀,弃上清;
(6)加入1 mL 75%乙醇(DEPC水或RNase-free水配制);
(7)4℃ 12000 g离心10 min,弃上清;5000 g快速离心1 s,小心吸尽液体;
(8)待RNA略干后(静置3 min),加入20 μL DEPC水或RNase-free水,将RNA洗脱下来,-80℃保存或直接进行反转录。
注意:①选择方案1(先洗脱再提取RNA),可能损失部分RNA;②如果RNA含量低,建议选择方案2(从磁珠上直接提取RNA),提取效率更高,但可能会增加非特异性。
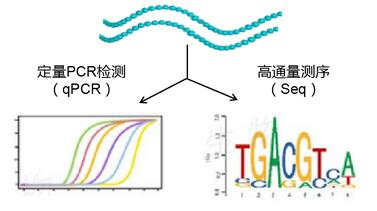
9 RNA分析
提取后的RNA、RNA input可用于qPCR实验或高通量测序。
1、在实验设计中,需要有蛋白input组、RNA input组、诱饵蛋白抗体RIP组(实验组)和IgG抗体阴性对照组(对照组)。
2、全程保持无酶,使用不含RNase的仪器、吸头和试管,裂解缓冲液和漂洗液中添加RNase抑制剂,防止RNA降解。
3、提取的RNA需无明显降解(琼脂糖电泳可见清晰的28S、18S rRNA条带),且纯度达标OD260/280≈1.8-2.0),否则会影响后续检测结果的准确性。
4、RIP后的RNA一般较微量,操作时注意勿把RNA沉淀吸走。
5、切勿让RNA过分干燥,否则将极难溶解,且测出的A260/A280值会低于1.6。
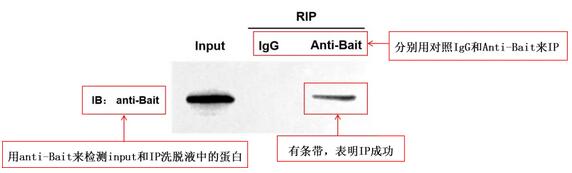
1 诱饵蛋白检测结果
Input组:利用Anti-Bait对样本裂解液进行WB检测,验证Input中是否存在Bait,从而确定蛋白的表达情况以及抗体效果;
IgG组(阴性对照组):排除非特异性结合的干扰,normal IgG不能富集Bait,一般不会有Bait条带,如果有条带说明Bait与beads或IgG有非特异性结合,需要重新完善下方法;
IP组(实验组):Anti-Bait可以特异性富集Bait,所以一定会有Bait条带,没有条带说明IP实验失败,需要复核IP流程,或检查Anti-Bait是否可以用于IP实验。
图5 诱饵蛋白Western blot检测结果图(验证是否IP成功)
2 待测基因检测结果
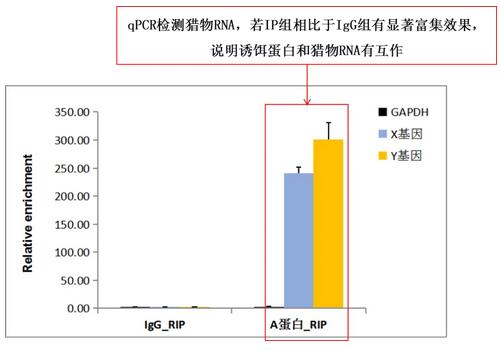
(1)qPCR检测(已知目标RNA)
Input组:实验起始的样本裂解液,用来校正RNA初始量差异,作为基础参照;
IgG组(对照组):normal IgG的RIP产物,用于排除非特异结合RNA的干扰,验证结果特异性;
Anti-Bait组(实验组):诱饵蛋白抗体的RIP产物,捕获与诱饵蛋白结合的RNA,用于目标检测。
计算公式:
①计算百分比Input
%Input=2(-ΔCt[normalized ChIP])x100%
②与阴性对照比较计算Fold Enrichment(倍数富集)
ΔΔCt[ChIP/阴性]=ΔCt[normalized ChIP] - ΔCt[normalized 阴性]
Fold Enrichment = 2^(-ΔΔCt[ChIP/阴性])
上图为RIP阳性结果示意图:表明诱饵蛋白可以与猎物RNA特异性结合,存在相互作用。
(2)高通量测序(RIP-seq,发现未知结合RNA)
结果判断:测序产生的原始数据(raw data)通过质量控制以及过滤,UMI解析和去重、纠错,获得高质量的测序数据(即clean data)。借助比对工具与研究物种的参考基因组进行比对,比对上的序列用于后续的生物信息学分析(包括read的分布和peak分析)。在全基因组范围对peak进行扫描,对扫描到的peak进行基因注释,GO、KEGG Pathway富集分析以及motif分析,深入解析RNA结合蛋白(RBP)的调控机制。
| |
| |
| |
| ChainFree® Flag-Tag RIP试剂盒 | |
| 服务项目 | |
| RIP qPCR(验证型) | RIP调取诱饵蛋白、qPCR检测IP产物中待验证的RNA |
| RIP调取诱饵蛋白、qPCR检测IP产物中待验证的RNA、Seq检测与分析 |
如果您在做RIP实验上还有疑问,欢迎咨询我们的技术人员。辉骏生物还提供各种类型蛋白互作试剂盒以及互作实验服务(RIP、RNA pull down、Chip、DNA pull down、IP实验),可根据实验需求定进行选择,助力您的科研更高效、更精准!










 实验热线:4006991663
实验热线:4006991663