Q1:目的蛋白结合效率低或不结合怎么办?
可能原因1:蛋白序列出现移码等错误
解决办法1:测序确认,调整阅读框以获得GST.Tag融合表达蛋白;选择适宜的宿主菌,如蛋白酶缺陷型大肠杆菌,稀有密码子宿主菌Rosetta系列。
可能原因2:融合蛋白可能改变了GST 的构象,因此降低了GST 标签蛋白的结合能力。
解决办法2:检测所使用的pGEX 载体中GST的结合。准备带有所使用的pGEX的细胞超声裂解物,检测其与层析柱的结合。如果结合的很好,则可能是标签蛋白改变了GST 的构象,因此降低了GST 标签蛋白的亲和力。可以通过降低结合的温度到4°C限制洗涤来改善结果。
可能原因3:GST 融合蛋白发生聚集沉淀
解决办法3:在裂解buffer和其他缓冲体系中加入DTT,经验告知,1-20mM的DTT 会显著增加某些GST融合蛋白的结合。
可能原因4:GST融合蛋白被过度稀释
解决办法4:重新浓缩样品,增加蛋白浓度。
可能原因5:GST 融合蛋白被机械裂解的方法变性(比如超声)
解决办法5:过度超声产热会破坏标签蛋白,建议采用超高压破碎。
可能原因6:结合缓冲条件不适宜
解决办法6:低于pH6.5或高于pH8时,融合蛋白与层析柱结合不充分导致结合效率低,请确认磁珠在用于目的蛋白纯化前经过pH6.5~8.0缓冲液充分的平衡。
可能原因7:层析柱使用次数过多,杂质干扰
解决办法7:层析柱再生或使用新的层析柱。
Q2:目的蛋白洗脱不下来或洗脱率低是什么原因导致的?
可能原因1:洗脱缓冲液的体积太少
解决办法1:增加洗脱缓冲液的体积。
可能原因2:洗脱缓冲液的pH过低
解决办法2:调节洗脱缓冲液pH值至8-9 。
可能原因3:洗脱的时间不够
解决办法3:增加洗脱缓冲液与磁珠反应的时间。
可能原因4:洗脱缓冲液中谷胱甘肽浓度太低
解决办法4:增加洗脱缓冲液中谷胱甘肽的浓度。
可能原因5:洗脱缓冲液中谷胱甘肽失效被氧化
解决办法5:洗脱缓冲液现配现用。
可能原因6:洗脱缓冲液的离子强度过低
解决办法6:增加洗脱缓冲液中的离子强度,在洗脱缓冲液中加入0.1~0.2M的氯化钠也会改善洗脱效果。
Q3:洗脱的蛋白中为什么含有杂质?
可能原因1:在宿主细菌中蛋白被降解
解决办法1:使用蛋白酶缺陷型菌株lon-或ompT,或ompT和lon双缺陷型菌株。
可能原因2:GST融合蛋白被蛋白酶部分降解
解决办法2:加入蛋白酶抑制剂PMSF。注:丝氨酸蛋白酶抑制剂必须在使用凝血酶或凝血因子Xa 前除去。
可能原因3:细胞破碎时超声处理过度
解决办法3:降低裂解时间,机械裂解前加入溶菌酶(0.1 倍体积的10 毫克/毫升溶菌酶溶液,溶菌酶保存在25mM Tris-HCl,pH8.0 )可能会使结果变好。避免发泡,因为这可能使标签蛋白变性。过分裂解也会导致宿主细胞蛋白和GST 标签蛋白共纯化。
可能原因4:分子伴侣或许被共纯化了
解决办法4:多余的条带可能由于共纯化一些分子伴侣所造成。这些分子伴侣参与大肠杆菌中新生成的蛋白的正确折叠。如:DnaK(分子量70
000)、DnaJ(分子量37 000)、GrpE(分子量40 000)GroEL (分子量57 000)、GroES(分子量10
000 )。一些从这些共纯化的蛋白中分离GST融合蛋白的方法已经发表。
Q4:如何解决目的蛋白酶切后电泳检测发现多条条带?
可能原因:蛋白酶切发生在宿主细菌内
解决办法:检测条带何时出现:如果确定多余的条带在Precission Protease,凝血酶,凝血因子Xa切割前不存在,这些条带可能是在宿主细菌中被降解的结果。目的蛋白可能含有Precission Protease,凝血酶,凝血因子Xa 的切割位点,请检查序列。
辉骏生物提供的GST Pull down实验技术服务分为以下两种:
1. GST Pull down WB,用于体外检测诱饵蛋白与某样本中的待测蛋白是否存在相互作用;
2. GST Pull down MS,用于体外筛选诱饵蛋白与某样本中的哪些蛋白具有相互作用。
GST pull down检测服务 |
| 服务项目 | 服务内容 | 结果交付 | 实验周期
| 客户提供 | 价格
|
| GST pull down WB | 构建诱饵蛋白的GST原核表达载体(可选做) | 载体质粒、甘油菌、测序结果和实验报告 | 约2周
| 1、含有诱饵基因序列的质粒模板及测序文件 2、实验样本 3、待测蛋白抗体 4、实验信息表(样本信息、诱饵蛋白和待测蛋白序列) |
|
| 原核表达诱饵蛋白并进行Western blot检测 | Western blot检测图 | 4-5周 |
| Western blot检测待测样本中的猎物蛋白 | Western blot检测图 |
GST pull down捕获诱饵蛋白及其互作蛋白 (2组:实验组、空载对照组) | pull down实验报告 |
| Western blot检测Pull down产物中的诱饵蛋白和待测蛋白 | Western blot检测图 |
GST pull down MS
| 构建诱饵蛋白的GST原核表达载体(可选做) | 载体质粒、甘油菌、测序结果和实验报告 | 约2周
| 1、含有诱饵基因序列的质粒模板及测序文件 2、实验样本 3、实验信息表(样本信息、诱饵蛋白序列) | |
| 原核表达诱饵蛋白并进行Western blot检测 | Western blot检测图 |
GST pull down捕获诱饵蛋白及其互作蛋白 (3组:实验组、空载对照组、裂解液对照组) | pull down实验报告 |
| Western blot检测pull down产物中的诱饵蛋白 | Western blot检测图 |
| LC-MS/MS定性检测pull down产物的蛋白、筛选实验组独有蛋白(潜在互作蛋白) | 质谱检索表格、互作蛋白筛选表格、检测报告 |
| 针对互作蛋白做生物信息学分析(GO、KEGG pathway、String) | 生物信息学分析结果和报告 | 1周 |
GST pull down技术服务优势*辉骏生物
近十年服务经验,众多服务案例,服务成果得到优秀期刊认可对蛋白互作的筛选鉴定理解深刻,擅长针对客户情况提出合适的方案建议自有分子及细胞生物实验平台,能有效制定并执行最优的实验路线自有蛋白质组学平台,对微量互作蛋白的质谱鉴定有十足的把控能力,对后续的生物信息分析有独到的见解售后技术支持将一直保持到客户发表文章,确保客户安心进行下游实验及投稿
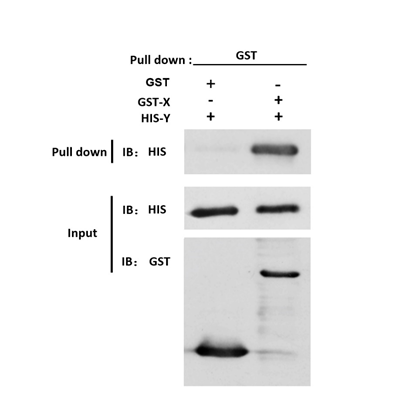
GST pull down WB:Western blot检测图(阳性)
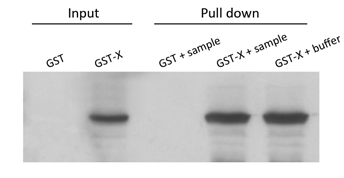
GST Pull-down MS:Western blot检测图
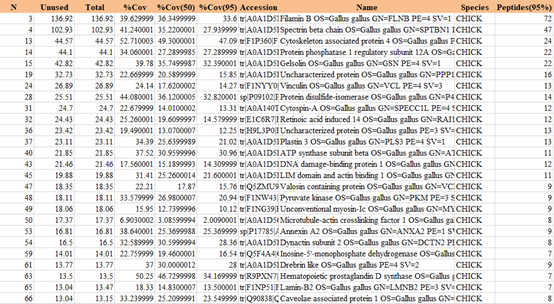
GST pulldown MS:质谱检索表格(部分展示)










 实验热线:4006991663
实验热线:4006991663