在细胞培养中使用氨基酸进行稳定同位素标记 (SILAC) 是一种基于质谱的强大方法,可识别和量化蛋白质丰度的相对差异变化。 2002 年首次用于定量蛋白质组学,它提供准确的相对定量,无需任何化学衍生或操作。
SILAC实验原理
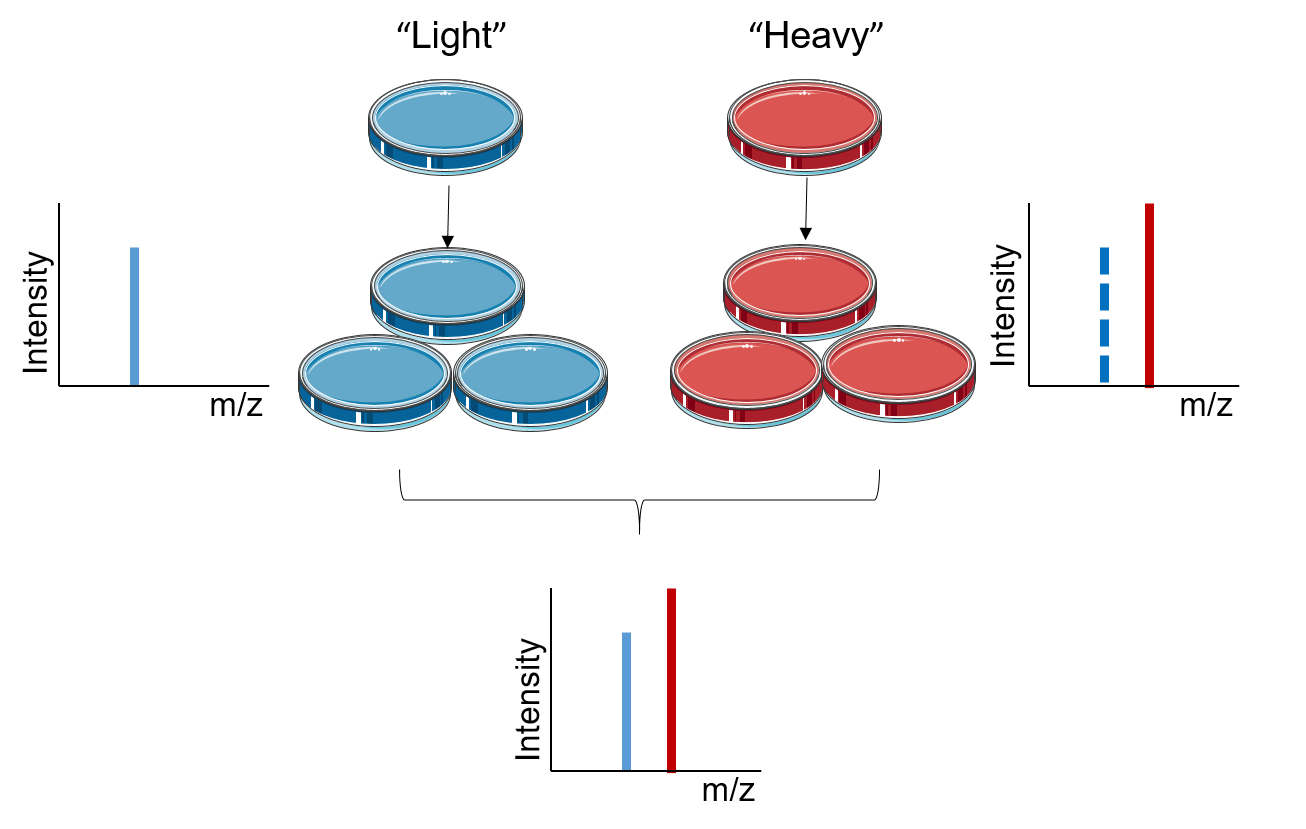
图 1. SILAC 的实验原理
SILAC原理是基于代谢将稳定同位素标记的氨基酸整合到整个蛋白质组中。 在 SILAC
中,两个细胞群在两种不同的培养基中生长,一种是含有天然同位素氨基酸的“轻”培养基,另一种是含有稳定同位素标记的氨基酸的“重”培养基。
在足够数量的细胞分裂后,在“重”培养基中培养的细胞中的所有蛋白质都含有处于重状态的氨基酸。 使用 LC-MS/MS 分析,SILAC
的定量基于测试引入的同位素标记肽与未标记肽的比率。 来自轻质和重质样品的信号强度可以定量比较它们在混合物中的相对丰度。
稳定同位素标记SILAC实验流程
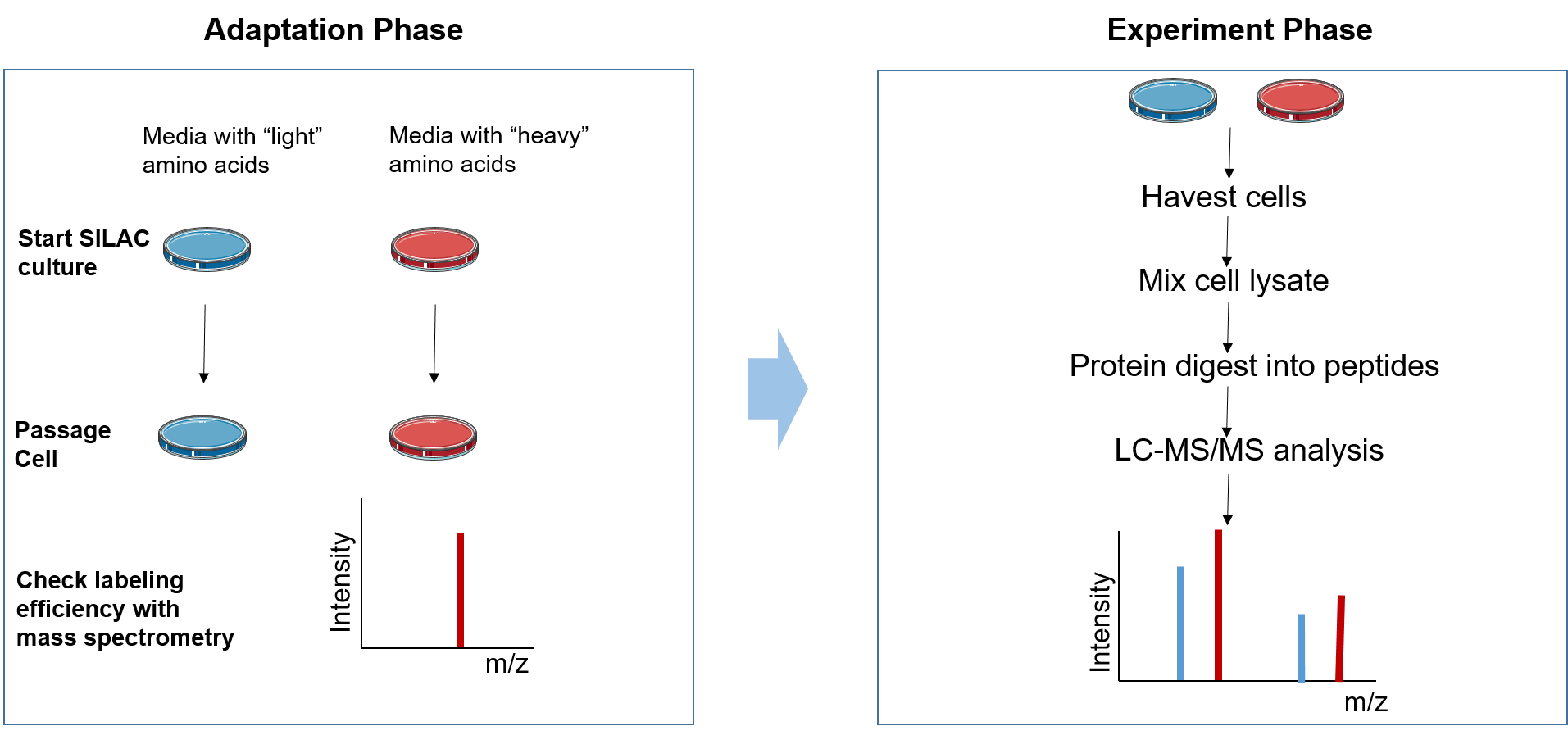
图2. 稳定同位素标记SILAC实验流程
SILAC实验可以分为两个阶段:适应阶段和实验阶段。
在适应阶段,细胞在轻质和重质 SILAC 培养基中生长,直到重质氨基酸完全掺入生长的细胞中,这可以通过 MS 进行评估。
在实验阶段,根据研究目的对两个细胞群进行不同的处理。 随后,研究混合细胞群或蛋白质裂解物。 然后用 LC-MS/MS
分析样品以识别和量化重肽与轻肽的比率。
SILAC的应用
SILAC 与 LC-MS/MS 联用已广泛用于表征不同样品之间的蛋白质定量差异,研究蛋白质翻译后修饰 (PTM) 的变化,以及区分蛋白质-蛋白质相互作用 (PPI) 网络中的特定相互作用蛋白质。 SILAC 有多种应用。
1. 表达蛋白质组学: SILAC 提供了一种 体内 策略来标记具有不同氨基酸稳定同位素形式的蛋白质,这使得在不同条件下监测蛋白质水平的定量差异成为可能。 此外,SILAC 还用于鉴定细胞器中差异表达的蛋白质,如细胞核、核仁或细胞胰岛素分泌颗粒。
2. PTM 的动态变化:
对于 PTMomics 分析,SILAC 标记肽需要经过分级分离和富集步骤,以改进 PTM 肽的鉴定。 结合 MS 技术,SILAC 可以对
PTM 进行全局和动态分析,包括磷酸化、乙酰化、糖基化、泛素化、甲基化。 例如,研究人员使用 SILAC 和固定化金属亲和层析 (IMAC)
进行磷酸肽富集,以量化 G 蛋白偶联受体信号通路中蛋白质响应酵母信息素信号的磷酸化变化。
3. PPI 研究:在研究 PPI 时,蛋白质复合物从 SILAC 标记的细胞裂解物的混合物中免疫沉淀。 结合
SILAC,可以有效地区分特异性相互作用的蛋白质和非特异性背景蛋白质。
从诱饵样品中纯化的特定相互作用伙伴的丰度显着高于从对照样品中纯化的,从而导致量化比率远高于
1。相比之下,诱饵和对照中非特异性背景蛋白的丰度应具有可比性样本,使得它们的比率接近 1。基于 SILAC 的定量蛋白质组学可用于鉴定研究外源性
PPI、内源性 PPI 或诱导型 PPI 中的特异性相互作用蛋白。
SILAC 是一种简单而强大的蛋白质定量分析方法,其特点是定量准确性和重现性。
差异处理的样品可以在完整细胞或蛋白质的水平上组合,即在实验工作流程的第一步,并且可以一起处理以最大限度地减少实验误差或偏差,但它只适用于细胞样本,细胞培养需要很长时间。
辉骏实力











 实验热线:4006991663
实验热线:4006991663






