中文标题:GYS2/p53负反馈环对HBV相关性肝细胞癌肿瘤生长的抑制作用
发表期刊:Cancer Research
中科院分区:1区
影响因子:13.312
发表时间:2018年8月
合作单位:中山大学肿瘤防治中心
运用技术:GST pull down WB,免疫共沉淀(Co-IP)(由辉骏生物提供技术支持)
● 研究背景
肝细胞癌(HCC)是全球第五大最流行的恶性肿瘤和第二大与癌症相关的死亡原因。它的发生归因于代谢物相关基因调控改变引起的细胞代谢重编程,有证据表明,糖代谢异常是癌症的突出特征,然而有关糖原调节的异常很少被研究。因此,明确这种异常代谢的机制或许可以为肝细胞癌的治疗提供新的靶点。
● 研究结果
1. 肝细胞癌中糖原含量降低
研究者通过PAS染色分析发现肝癌组织中的糖原与非肿瘤组织相比明显减少(图1A)。对768例HCC患者组成的样本进行PAS染色,根据阳性染色比例将患者分为高PAS组和低PAS组,Kaplan-Meier分析显示低PS染色与总体生存情况不良相关(图1D),多变量Cox回归模型进一步显示糖原含量是HCC总生存率的独立预后因素。这些数据表明,肝细胞癌中糖原合成受到抑制。
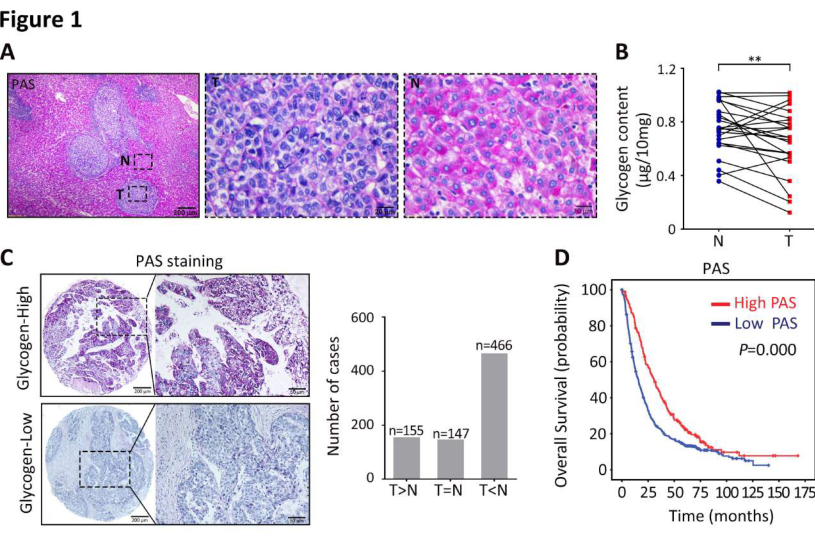
图1
2. GYS2在肝细胞癌中降低,并与不良患者预后相关
8对肝癌组织的转录图谱显示,涉及糖原合成和代谢的基因被解除了调控。其中,GYS2在肿瘤组织中显著下调(图2A)。在HCC新鲜组织中,与匹配的非肿瘤组织(图2B)相比,近3/4的病例中GYS2 mRNA表达降低;GYS2蛋白水平在全部HCC标本中显著降低,并且与糖原含量呈正相关(图2C,D);在63.0%(481/763)的HCC中,GYS2表达明显下调(图2E)。GYS2在60.6%(462/763)的HCC组织中低表达,常见于PAS染色较弱的病例(图2F)。Kaplan-Meier分析显示,GYS2缺乏的患者在SYSUCC和癌症基因组图谱中的总体存活率都不佳(图2G)。多变量Cox回归模型和分层生存分析进一步表明GYS2是影响HCC总生存率的独立预后因素。
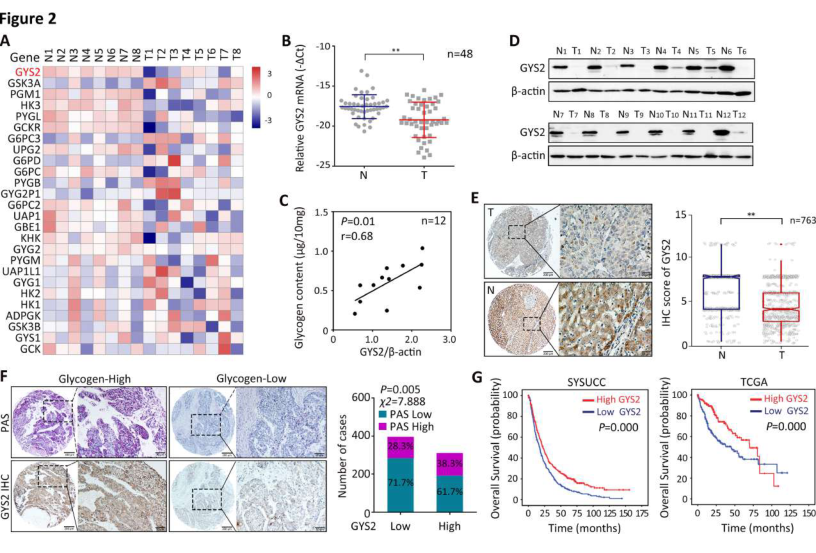
图2
3. GYS2缺失促进肝癌体内外增殖
为了探讨GYS2在HCC中的生物学功能,研究者在HepG2和QGY-7703细胞中敲除GYS2,在Bel-7402和Bel-7404细胞中过表达GYS2(图3A)。细胞活力在GYS2沉默的细胞中显着增加,但在过表达GYS2的细胞中下降(图3B)。GYS2基因敲除可显著诱导EDU阳性细胞,而GYS2过表达可使EDU阳性细胞减少(图3C)。GYS2沉默后,细胞阻滞于S-G2-M期,而过表达GYS2则导致更多的细胞处于G0-G1期(图3D)。此外,GYS2缺失的细胞形成了更多的集落,而GYS2的异位表达削弱了HCC细胞的增殖(图3E)。为了在体内验证这些效应,研究者建立了裸鼠皮下注射细胞的异种移植模型。与对照组相比,GYS2沉默的荷瘤细胞生长更快,糖原含量更少,Ki-67表达更高(图3F)。这些发现表明,缺乏GYS2极大地促进了肝癌细胞的生长。
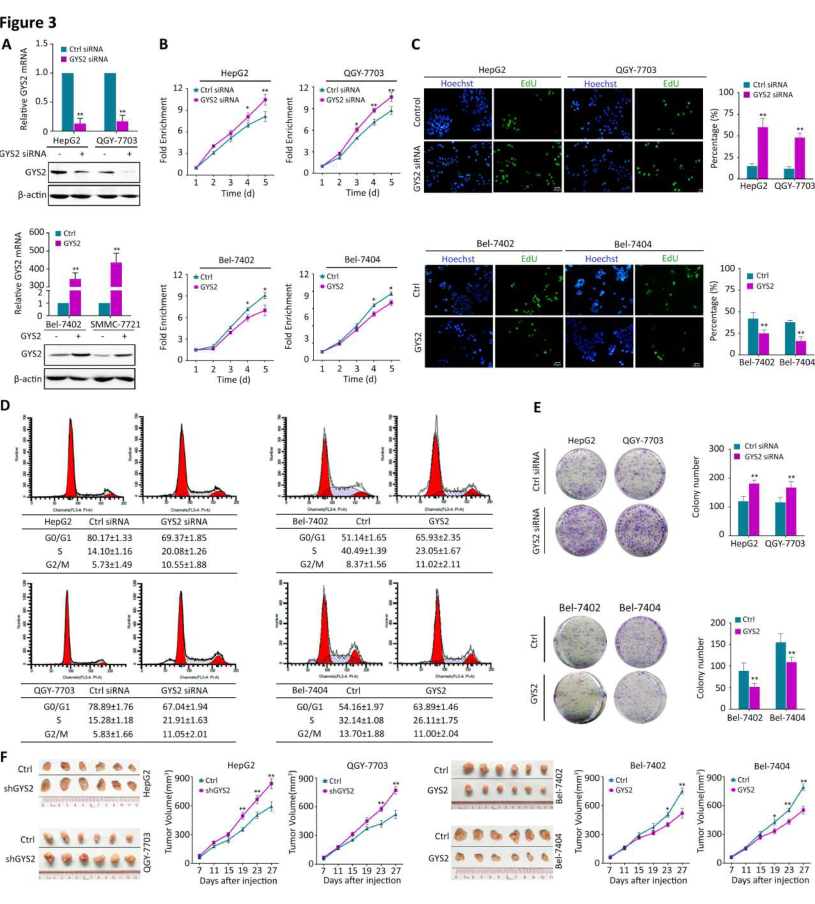
图3
4. GYS2激活p53信号通路
为了揭示GYS2介导的肝癌增殖的潜在机制,研究者在HepG2和QGY-7703细胞中进行了RNA seq分析。结果显示,在GYS2缺失的两种细胞系中,p53通路都受到了明显抑制(图4A),GYS2的过表达诱导p53蛋白水平,导致p53靶基因的调控,如p21,14-3-3S和cyclin D1(图4B)。接下来研究者通过Co-IP研究了这两个蛋白之间的相互作用(图4C),又通过GST pull-down实验证实了GYS2与p53的直接结合(图4D和E)。进一步确定相互作用的区域,结果显示,p53的1-101aa区和GYS2的1-500aa区是GYS2-p53结合所必需的(图4F和G)。为了验证GYS2是否通过p53发挥抗肝癌作用,研究者进行了挽救实验。恢复p53表达可部分减弱GYS2缺失对HepG2和QGY-7703细胞生长的促进作用。这些数据表明,GYS2在肝癌细胞中通过与p53的相互作用发挥肿瘤抑制作用。
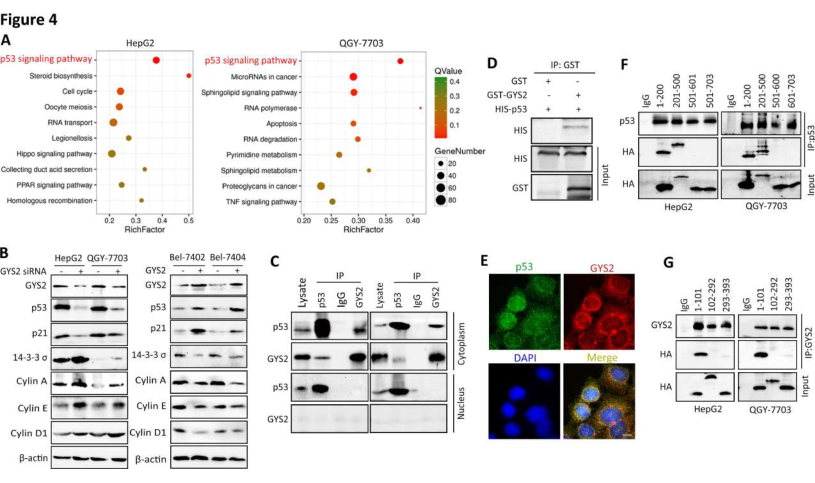
图4
5. GYS2通过与MDM2的竞争性相互作用稳定p53
为探索GYS2上调p53的机制,研究者通过使用环己胺处理,发现GYS2过表达显著延长了肝癌细胞中p53蛋白的半衰期(图5A)。用蛋白酶体抑制剂MG-132预孵育细胞,Co-IP结果显示,泛素介导的p53蛋白酶体降解被GYS2沉默增强,但被异位GYS2表达减弱(图5B)。转染GYS2 siRNA,用MG-132预孵育后进行Co-IP实验,再次检测GYS2对p53泛素化的影响。结果显示MG132可取消GYS2 siRNA诱导的p53降低(图5C)。E3泛素连接酶MDM2在p53泛素化过程中起着关键作用,为确定MDM2是否参与了GYS2对p53的调控。研究者在MDM2诱导下,再次检测了GYS2对p53泛素化的影响。结果显示GYS2部分减弱了MDM2介导的p53泛素化,GYS2 siRNA阻断了MDM2 siRNA诱导的p53泛素化抑制(图5D)。用MDM2 siRNA处理细胞后再敲除GYS2,WB检测P53蛋白表达,结果显示SiRNA对MDM2的抑制显著抑制了GYS2 siRNA对p53的下调(图5E)。接下来,研究者通过Co-IP法检测了GYS2、MDM2和P53细胞中的相互作用(图5F),结果所示,GYS2、p53和MDM2通过相互结合形成了蛋白质复合物。GST pull-down实验也证实了GYS2与MDM2的直接结合(图5G)。此外,MDM2和p53之间的相互作用因GYS2的下调而增强,但因GYS2在HCC细胞中的过表达而减少(图5H和I)。这些数据表明,GYS2通过竞争性地与MDM2结合来抑制p53泛素化从而稳定p53蛋白。
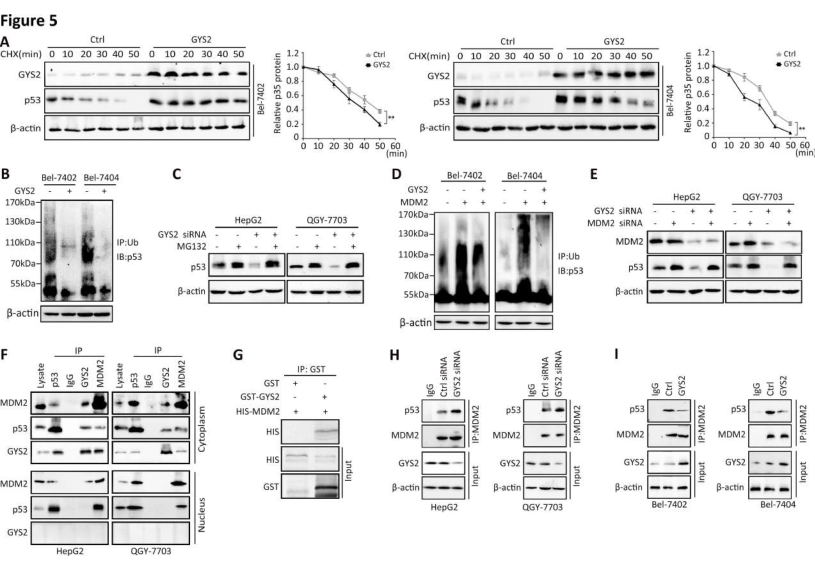
图5
6. P53通过依赖p300的负反馈环抑制GYS2
鉴于GYS2在p53介导的异常糖原代谢中的作用。qRT-PCR和WB分析检测GYS2 在p53过表达或沉默的情况下的表达,结果显示,p53的敲除上调了GYS2的mRNA和蛋白水平(图6B)。双荧光素酶分析表明,p53转染降低了GYS2启动子的活性(图6C)。CHIP分析也证实了p53与GYS2启动子结合(图6D)。p53的转录后修饰是其转录功能所必需的,p300介导的p53乙酰化增强了其反式激活靶的DNA结合能力。转染GYS2后检测4个p53乙酰化赖氨酸位点的表达,结果显示,GYS2过表达增加了赖氨酸373/382处的p53乙酰化(图6E),这一作用被p300的敲除所阻断(图6F)。用特异性p300抑制剂C646或p300 siRNA处理细胞,可以消除p53介导的GYS2下降(图6G)。研究者进一步构建了不能被p300乙酰化的p53K373A和p53K382A突变,这两个p53突变体的转染导致GYS2 mRNA和蛋白的减少较少(图6H),此外,在p53K373A或p53K382A表达的细胞中,p53对GYS2启动子的抑制作用和结合减弱(图6I和J)。这些结果表明,在负反馈环中,p53通过p300介导的乙酰化在转录上抑制GYS2。
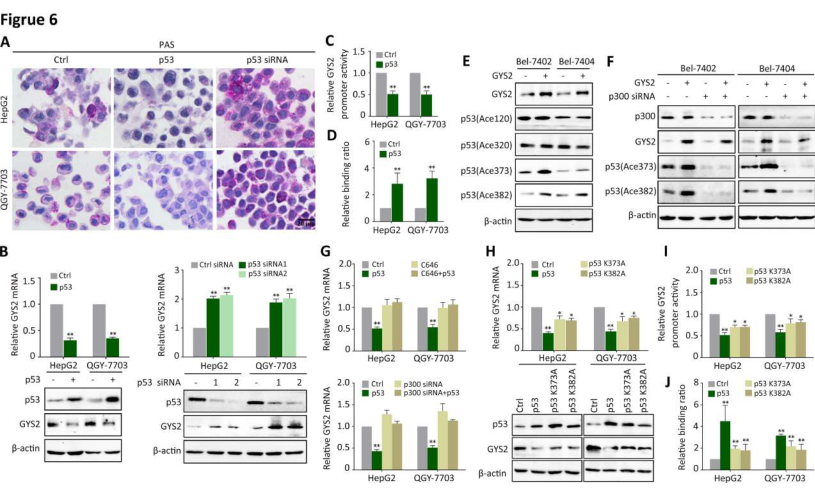
图6
7. HBx-HDAC1复合物促进p53介导的GYS2抑制作用
HBV编码的关键致癌蛋白HBx在糖原代谢中的作用尚不明确。分别在HepG2细胞中过表达HBx,在HepG2.2.15细胞中敲除HBx,PAS染色显示糖原含量,结果显示HBx过表达减少了HCC细胞中的糖原含量,而HBx的敲除恢复了这一趋势(图7A)。在HBx阳性的病例中,GYS2的低表达和PAS染色更常见(图7B),而在HBx阴性的HepG2和QGY-7703细胞中,引入HBx下调了GYS2的表达(图7C)。据报道,HBx的活性抑制需要招募协同因子,而组蛋白去乙酰化酶(HDAC)是与HBx相互作用的主要基因抑制因子。研究者用siRNA处理HepG2.2.15和HepG2-HBx细胞,Co-IP实验显示了HBx、HDAC1和细胞核内乙酰化的p53之间的相互作用(图7D)。在HBx过表达的细胞中,HDAC1或p53的敲除部分减弱了GYS2 mRNA的减少(图7E)。荧光素酶和CHIP分析表明,HDAC1或p53的敲除降低了HBx与GYS2启动子的结合(图7F和G)。这些数据表明,HBx与HDAC1共同作用于p53介导的抑制HBV阳性肝癌中GYS2的表达。
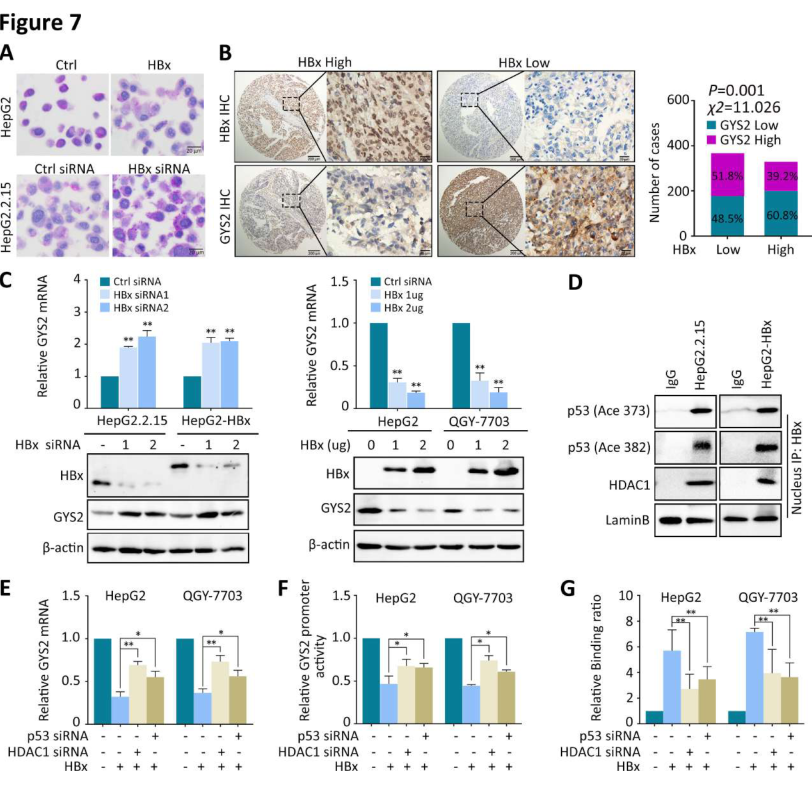
图7









 实验热线:4006991663
实验热线:4006991663











