中文标题:AR诱导的长非编码RNA LINC01503促进鼻咽癌SFPQ-FOSL1轴的增殖和转移
发表期刊:Oncogene
中科院分区:1区
影响因子:8.756
发表时间:2020年1月
合作单位:中山大学肿瘤防治中心
运用技术:RNA pull-down MS结合蛋白鉴定(由辉骏生物提供技术支持,点击查看服务详情)
● 研究背景
鼻咽癌(NPC)是一种起源于鼻咽腔粘膜的上皮性恶性肿瘤,局部复发和远处转移是鼻咽癌死亡的两个主要原因。因此,识别鼻咽癌复发转移的关键生物标志物及其机制,对鼻咽癌患者个体化治疗的发展具有重要意义。
本研究发现LINC01503在NPC中高表达并与不良预后有关,在体外促进NPC细胞的增殖,迁移和侵袭,在体内促进肿瘤的生长和转移。LINC01503募集了SFPQ来激活FOSL1转录。雄激素受体(AR)激活了NPC细胞中LINC01503的转录,导致AR配体依赖性的细胞生长、迁移和侵袭。
这些发现表明,AR诱导的LINC01503可以通过SFPQ-FOSL1通路促进NPC发展,或成为新的NPC预后标志物和治疗靶标。
● 研究结果
1. LINC01503在鼻咽癌中高表达,与预后不良相关
在先前的全基因组lncRNA图谱中发现,LINC01503在鼻咽癌组织中高表达(图1A)。为了证实这一结果,研究者用定量RT-PCR方法检测了20例鼻咽癌组织和16例正常鼻咽组织中LINC01503的表达水平。结果表明,LINC01503在鼻咽癌组织中明显过表达(图1B);此外,与正常鼻咽上皮细胞NP69和N2Tert相比,LINC01503在11个鼻咽癌细胞系中表达显著上调(图1C)。后续临床分析结果表明,LINC01503水平高的患者总体、无病和无远处转移的生存率比LINC01503水平低的患者差(图1D-F)。研究者结合LINC01503的表达和TNM分期数据,构建了一个预测鼻咽癌(214例)预后的模型,将鼻咽癌患者分为三组,Kaplan-Meier曲线显示这三组鼻咽癌患者的生存前景不同(图1G-I)。综上所述,这些发现表明LINC01503在鼻咽癌中高表达,可作为判断鼻咽癌预后的生物标志物。
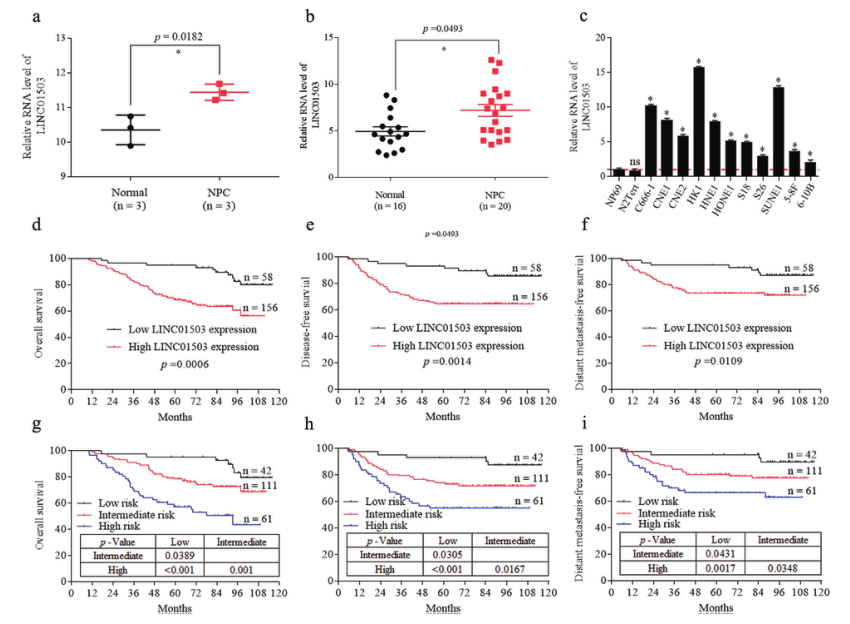
图1
2. LINC01503促进鼻咽癌细胞体外生长、迁移和侵袭
为了确定LINC01503在鼻咽癌中的潜在作用,研究者在HK1细胞中特异性地下调了内源性LINC01503的表达,然后进行RNA-seq以确定LINC01503被敲除后所影响的下游基因。针对这些基因的生物信息学分析结果表明,LINC01503与鼻咽癌的进展密切相关(图2A)。为了验证这些发现,研究者使用两种不同的shLINC01503质粒瞬时下调了LINC01503在HK1和SUNE1细胞中的表达,并进行了体外功能分析(图2B)。结果进一步表明,LINC01503基因的敲除显著抑制了鼻咽癌细胞的生长、增殖迁移与侵袭能力(图2C-F)。
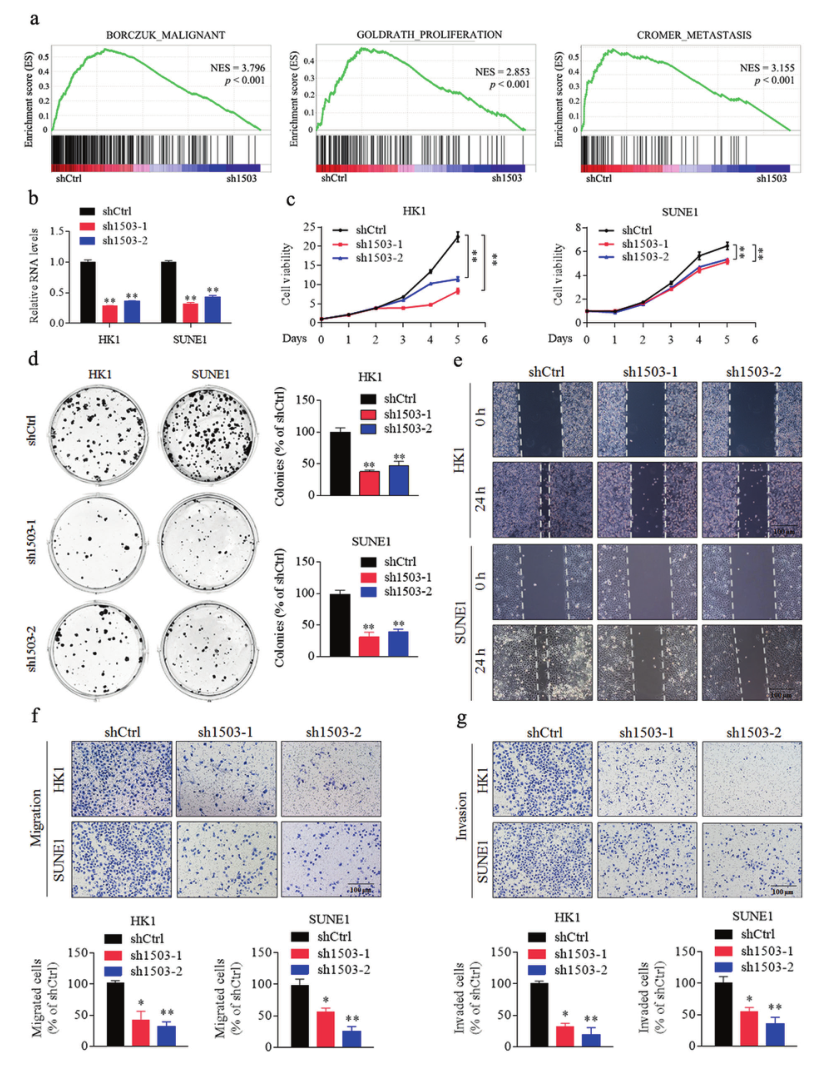
图2
3. LINC01503与SFPQ直接结合
已有报道表明,LncRNA通过与特定蛋白相互作用而发挥功能。研究者使用生物素标记的LINC01503正义或反义序列进行RNApull down实验,然后进行质谱分析鉴定与LINC01503相互作用的蛋白(图3B)。结果表明,剪接因子SFPQ是高度富集的蛋白之一(图3C)。为进一步验证LINC01503与SFPQ之间的相互作用,研究者用抗SFPQ抗体进行了RIP实验,发现LINC01503 RNA明显富集(图3D),敲除LINC01503后LINC01503与SFPQ之间的相互作用消失(图3E)。接下来,为确定LINC01503与SFPQ结合所需的特异性片段,研究者构建了一系列LINC01503截短质粒并进行了RNA pull down实验,发现LINC01503的敲除或过表达既不影响SFPQ mRNA水平,也不影响SFPQ蛋白水平(图3H,I)。这些结果表明,LINC01503可以直接与SFPQ结合。
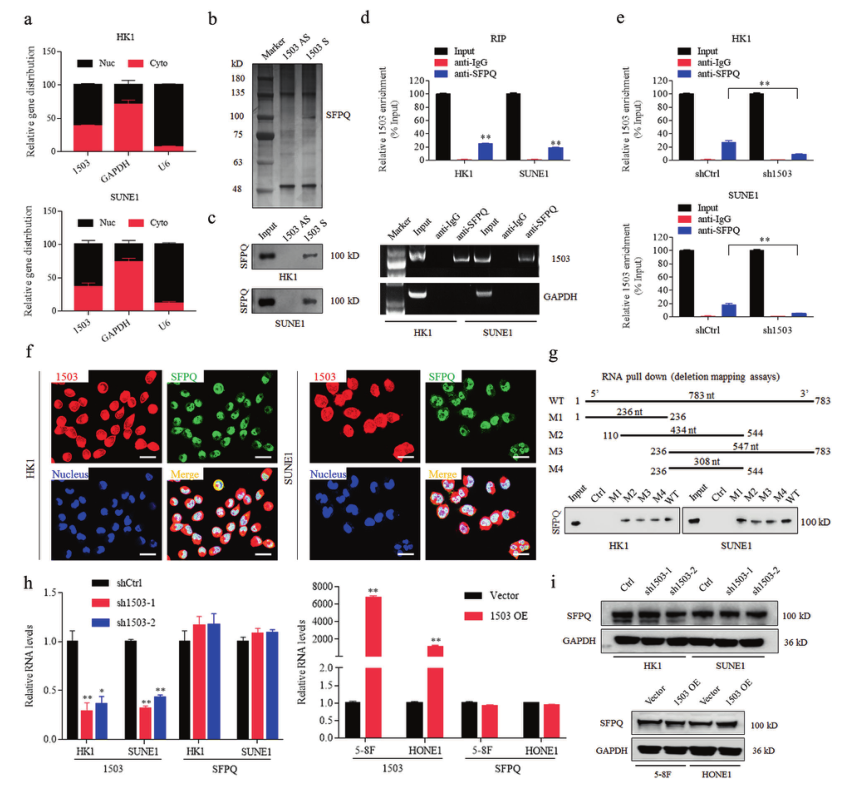
图3
4. LINC01503招募SFPQ激活FOSL1转录
作为一种多功能核蛋白,SFPQ可以作为转录抑制因子或激活因子来调节基因表达。为了确定LINC01503/SFPQ在鼻咽癌中的靶基因,研究者分析了LINC01503基因敲除前后HK1细胞的RNA-seq数据。在前20个上调和下调的基因中,FOSL1在鼻咽癌组织中过表达,且与LINC01503的表达呈正相关(图4B,C)。LINC01503或SFPQ的敲除都能降低FOSL1mRNA和蛋白水平(图4D,E)。接下来,Transfac和Weblogo程序预测到在FOSL1基因的启动子区域有两个SFPQ结合位点(图4F,G)。ChIP-PCR结果表明,LINC01503基因敲除后,FOSL1启动子区域的SFPQ富集现象可被显著消除(图4H)。此外,荧光素酶报告分析表明,过表达SFPQ显著提高了FOSL1野生型启动子结构的荧光素酶活性,但不能增加突变报告结构的荧光素酶活性(图4I)。最后,DNase I酶切分析表明,LINC01503或SFPQ基因敲除显著抑制了FOSL1启动子位点的染色质可及性(图4J)。这些结果表明,LINC01503可以招募SFPQ激活FOSL1转录活性并增加其表达。
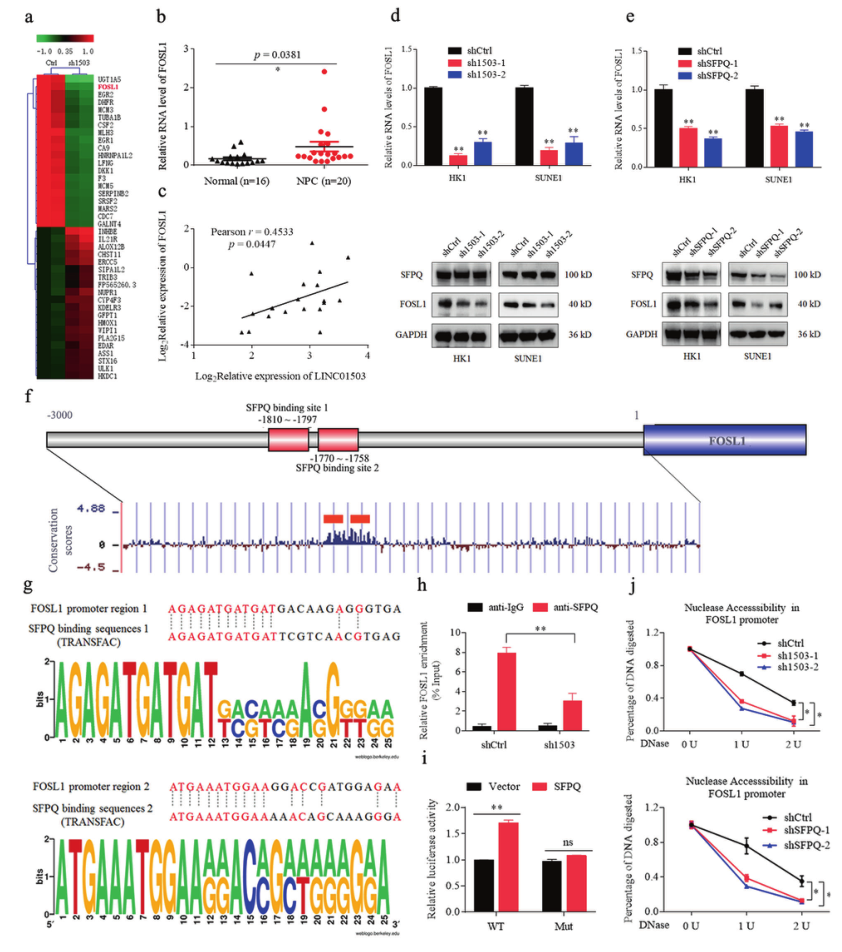
图4
5. FOSL1负责LINC01503/SFPQ介导的鼻咽癌进展
为了确定LINC01503/SFPQ是否通过激活FOSL1促进鼻咽癌的进展,研究者在HK1和SUNE1细胞中引入FOSL1过表达或空载体,稳定下调LINC01503(Sh1503)或其对照(ShCtrl),CCK-8和集落形成实验表明,过表达FOSL1可以解除LINC01503基因敲除对细胞生长和增殖的抑制作用(图5A-C)。Transwell分析表明,LINC01503的过表达逆转了LINC010503基因敲除对鼻咽癌细胞迁移和侵袭能力的抑制作用(图5D)。这些结果表明,LINC01503通过激活FOSL1促进鼻咽癌的进展。
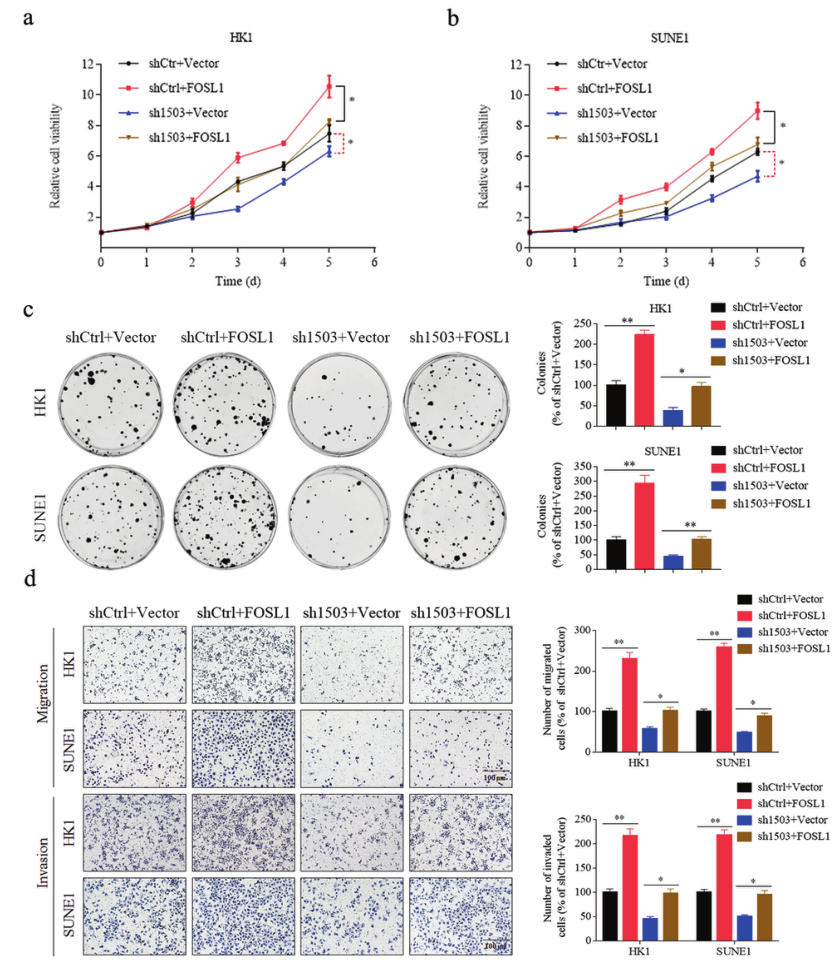
图5
6. LINC01503敲除对鼻咽癌肿瘤生长和转移的抑制作用
为确定LINC01503在鼻咽癌生长和转移中的作用,研究者建立了肿瘤生长模型。结果表明,LINC01503基因的敲除显著延缓了肿瘤的生长,并在大小上明显小于对照组(图6A-C)。接下来,研究者建立了腹股沟淋巴结转移模型(图6D),结果显示LINC01503基因敲除组腹股沟淋巴结较小,重量较轻(图6E,F);肿瘤侵袭性较弱,对皮肤和肌肉的侵袭能力减弱(图6G);腹股沟淋巴结转移率明显低于对照组(图6H,I)。还建立了肺转移定植模型,结果表明LINC01503基因敲除组肺表面转移结节较对照组少(图6J,K),转移结节较对照组明显减少和缩小(图6L)。这些数据均表明,LINC01503在体内促进了鼻咽癌肿瘤的生长和肺转移。
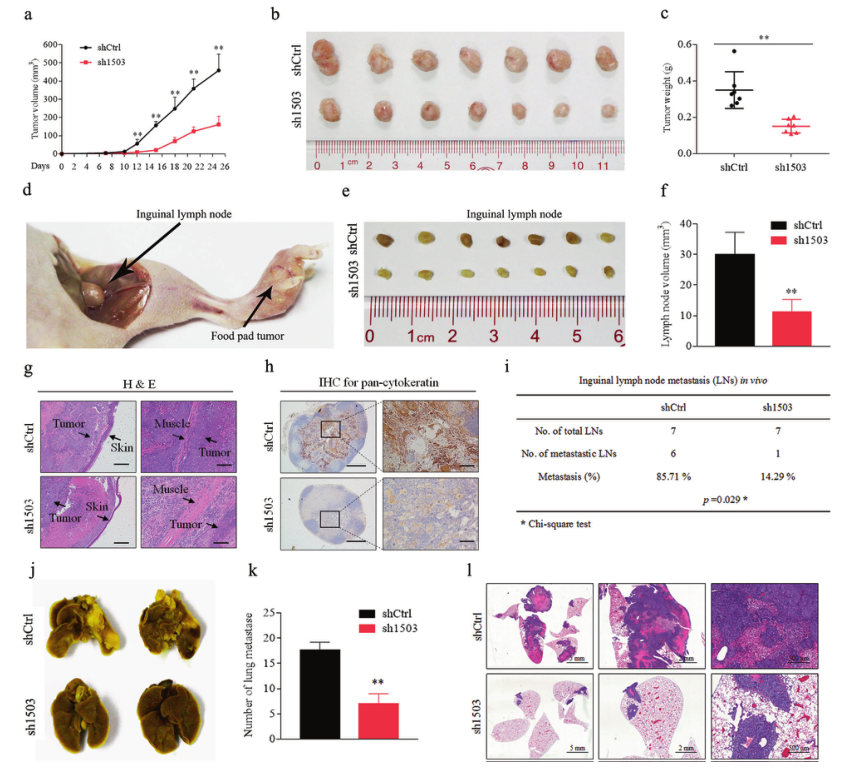
图6
7. AR激活LINC01503转录以增加其在鼻咽癌中的表达
使用Jaspar软件对LINC01503的启动子进行分析,预测了两个转录因子:ALX Homeobox 3(ALX3)和AR(图7A)。研究者发现AR的敲除明显降低了LINC01503在HK1和SUNE1细胞中的表达,ALX3的敲除则没有(图7B)。此外,AR的过表达增加了LINC01503的RNA表达(图7C)。更重要的是,AR在鼻咽癌中表达上调,并与LINC01503的表达呈正相关(图7D,E)。研究者用Jaspar软件预测了LINC01503启动子区域的两个高亲和力结合位点(图7F),CHIP-PCR显示AR的异位表达显著增强了其在LINC01503启动子区域的富集(图7G)。荧光素酶报告实验结果表明,AR的敲除显著降低了野生型LINC01503启动子结构的荧光素酶活性,但没有降低突变报告结构的荧光素酶活性(图7H)。最后,通过DNase I酶切实验,研究者观察到AR基因敲除显著抑制了LINC01503启动子位点的染色质可及性(图7I)。这些结果说明AR激活了鼻咽癌LINC01503的转录。
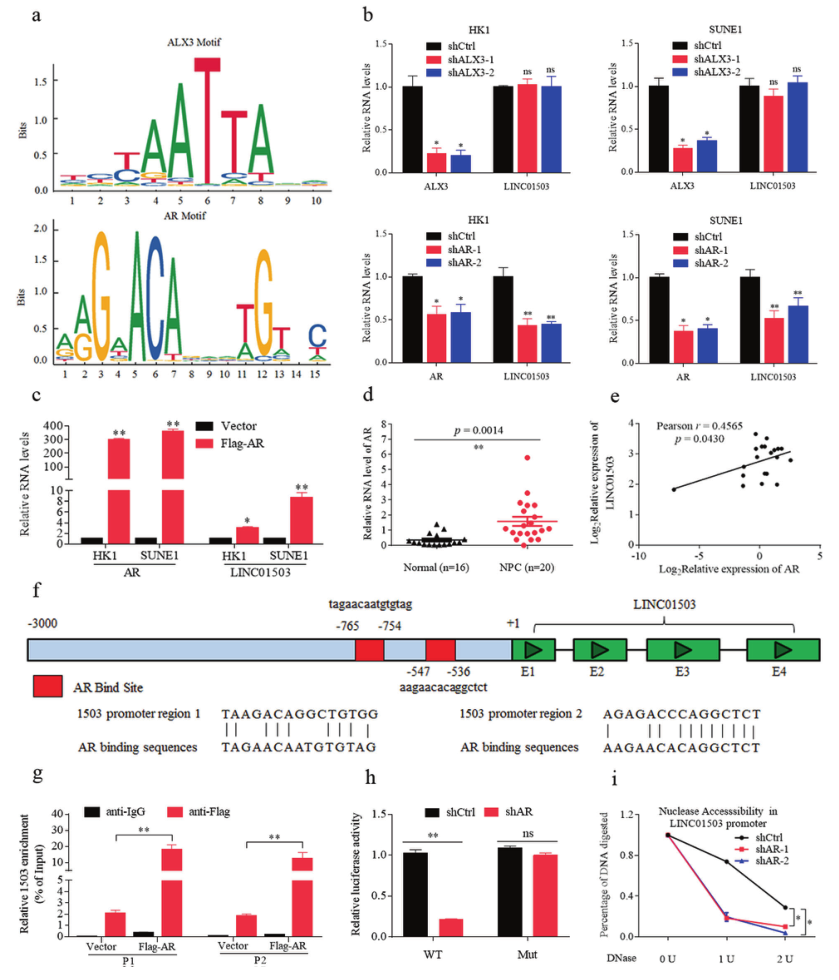
图7
8. AR拮抗剂ENZ可能通过阻断LINC01503的上游转录来抑制鼻咽癌的恶性进展
为了进一步阐明LINC01503的AR配体依赖性激活,研究者进行了AR反应和抑制试验。结果表明,在AR激动剂双氢睾酮(DHT)处理过程中,LINC01503呈时间依赖和剂量依赖的激活;在拮抗剂苯扎鲁胺(ENZ)存在下,LINC01503呈时间依赖和剂量依赖的抑制(图8A,B)。有趣的是,DHT处理导致细胞功能的激活,而AR处理则导致细胞功能的抑制(图8C-E),接下来,研究者研究了LINC01503的表达对ENZ抑制的鼻咽癌细胞恶性表型的影响,发现ENZ抑制的细胞生长、迁移和侵袭可以通过增加LINC01503在细胞中的表达来逆转(图8F-H)。这些结果证实了AR拮抗剂ENZ可能通过阻断LINC01503的上游转录来抑制鼻咽癌的恶性进展。
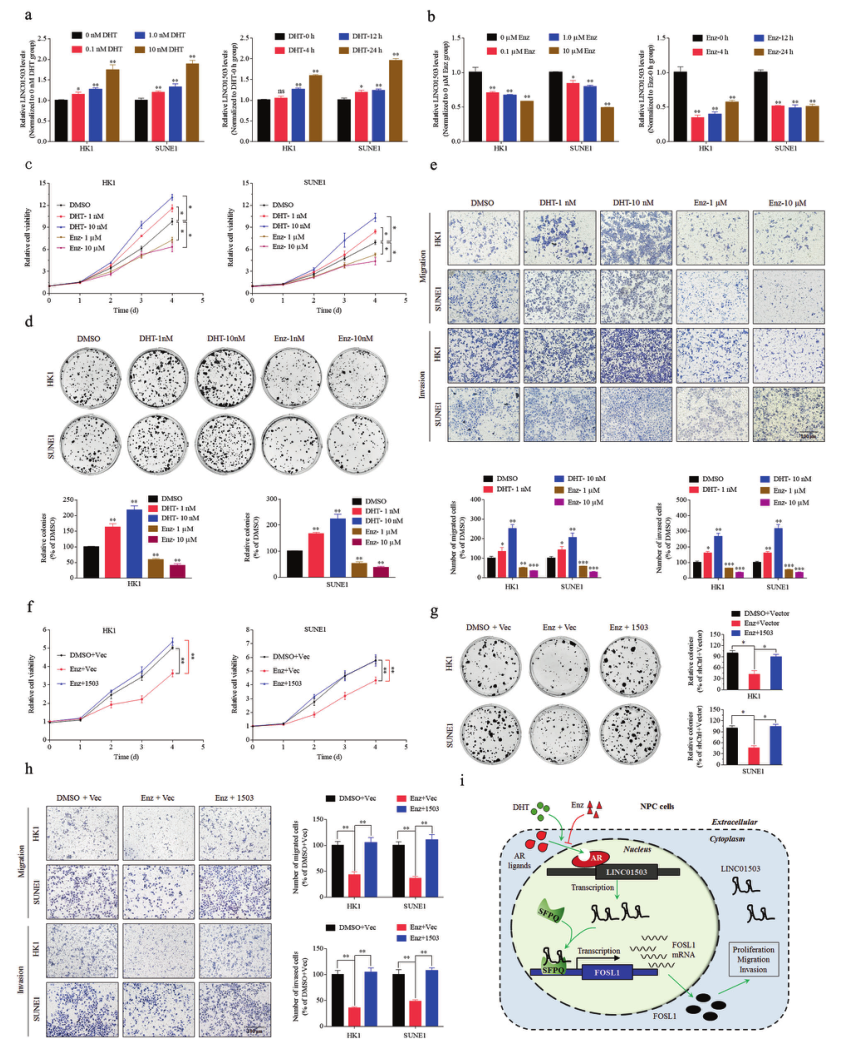
图8









 实验热线:4006991663
实验热线:4006991663












