Wang W.J. et al: Endonuclease G promotes autophagy by suppressing mTOR signaling and activating the DNA damage response
中文标题:内切酶G通过抑制mTOR信号传导和激活DNA损伤反应来促进自噬
发表期刊:Nature Communications
中科院分区:1区
影响因子:17.694
发表时间:2021年8月
合作单位:暨南大学
运用技术:LC-MS/MS蛋白质谱鉴定(由辉骏生物提供技术支持,点击查看服务详情)
研究概述:
内切酶G (ENDOG)是一种线粒体核酸酶,已知参与许多细胞过程,但其在自噬中的作用尚不清楚。本研究发现线粒体释放的ENDOG促进饥饿期间的自噬。通过对人类细胞系、小鼠、果蝇和秀丽隐杆线虫的实验发现,这种自噬在物种间是进化保守的。在饥饿状态下,糖原合成酶激酶3-β介导的ENDOG在Thr-128和Ser-288位点的磷酸化增强了其与14-3-3γ的相互作用,导致14-3-3γ释放Tuberin (TSC2)和磷脂酰肌醇3-激酶催化亚基3 (Vps34),随后mTOR途径被抑制并开始自噬。或者,ENDOG通过其内切酶活性激活DNA损伤反应并引发自噬。
研究结果:
1、ENDOG促进肝细胞中的自噬流
先前的研究证明ENDOG同源物CPS-6在秀丽隐杆线虫受精时能调控自噬作用,那么ENDOG是否也能调控一般自噬呢?在人肝细胞系(L02和HepG2)中过表达ENDOG显著增加了LC3B-II积累,降低了自噬底物SQSTM1表达,促进了自噬体形成(图1a-d),而干扰ENDOG显著抑制了许多核心ATG蛋白的表达和磷酸化。mCherry-GFP-LC3双荧光指示实验表明ENDOG过表达能增强肝细胞中的自噬流。ENDOG敲除细胞系在正常和应激条件下(饥饿、雷帕霉素和CQ处理)的自溶体形成被显著抑制(图1e-m),表明ENDOG促进自噬流。
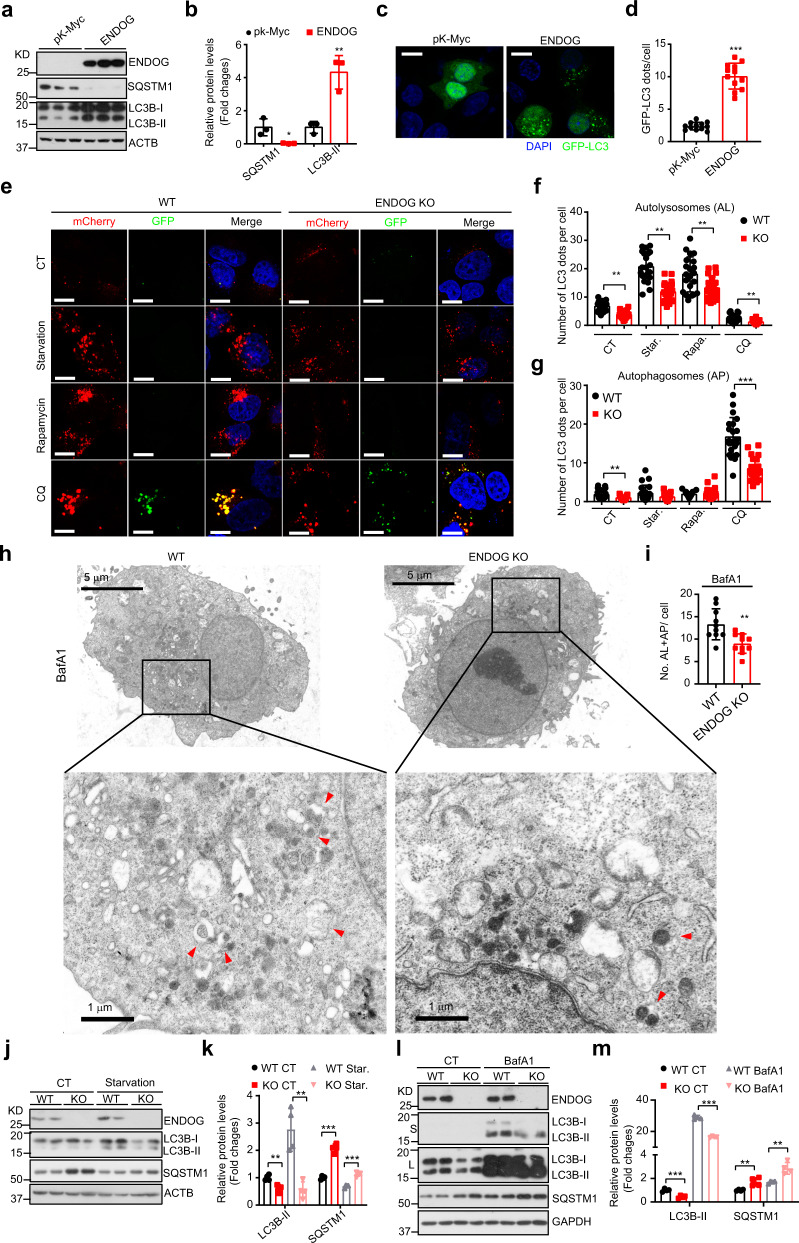
图1
2、ENDOG缺失抑制了多种物种中饥饿诱导的自噬
接着,研究者进一步探索了ENDOG在体内能否促进自噬以及该功能在不同物种间是否保守。与对照组相比,ENDOG敲除小鼠在饥饿处理后,其肝脏中的LC3B积累减少,SQSTM1表达增加,自噬小泡数量减少(图2a-d)。饥饿处理后,ENDOG敲低果蝇的脂肪体细胞中mCherry-Atg8a(LC3同源物)的积累比未敲低组少(图2e)。在正常和饥饿条件下,秀丽隐杆线虫中ENDOG同源物cps-6的缺失均显著降低了GFP的水平(图2f);在侧线细胞和咽肌中,cps-6的缺失抑制了GFP::LGG-1(LC3同源物)点的数量(图2g-h)。这些结果表明,在小鼠、果蝇和秀丽隐杆线虫中,ENDOG促进自噬这一功能是保守的。
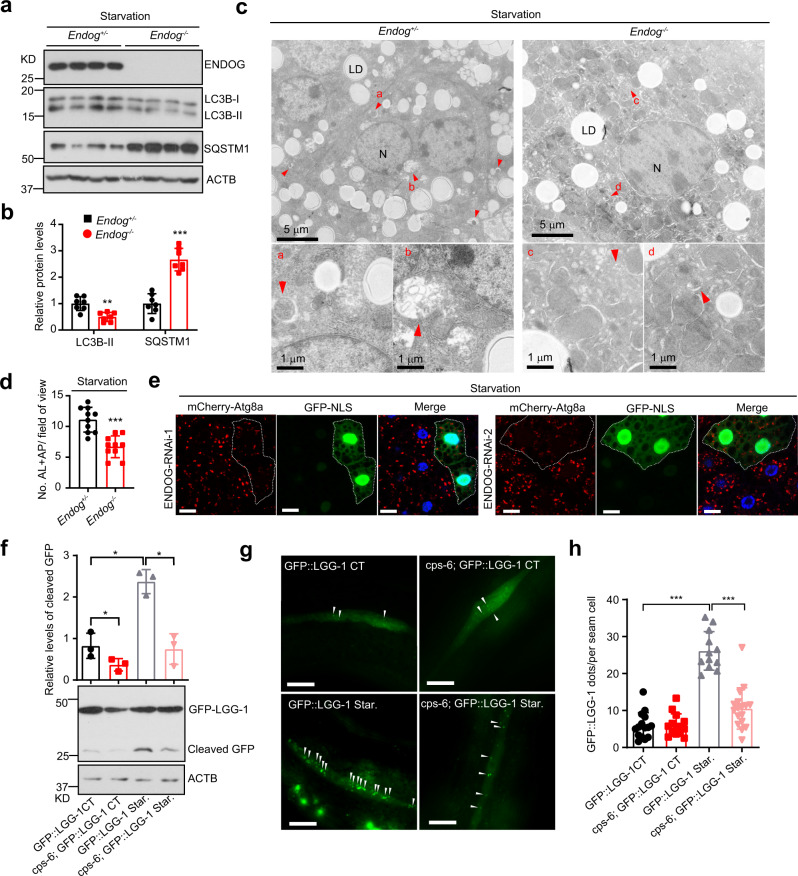
图2
3、ENDOG通过抑制mTOR信号通路促进部分自噬
为了探索ENDOG诱导自噬的机制,研究者检测了mTOR信号通路(自噬负调节因子)的参与情况。在人正常肝细胞L02及其他肝癌细胞系中,ENDOG的缺失都增加了mTOR及其底物的磷酸化水平(图3a,b)。ENDOG敲除小鼠肝脏中的mTOR及其底物的磷酸化显著增加(图3c,d)。当使用RHEBQ64L来持续激活mTOR,发现其部分恢复了mTOR活性(图3e、f),降低了ENDOG过表达细胞中LC3B-II的积累和自噬体的形成(图3e–h)。但在ENDOG过表达的细胞中,LC3B-II的积累和自噬体的数量仍然多于RHEBQ64L过表达的野生型细胞。这些数据表明,ENDOG可部分通过抑制mTOR信号来促进自噬。
4、ENDOG通过与14-3-3γ相互作用抑制mTOR通路
随后,研究人员进行了ENDOG的免疫共沉淀和质谱(IP-MS)法来进一步探索ENDOG通过mTOR促进自噬的机制。他们在质谱结果中发现可以调控mTOR活性的14-3-3γ。Co-IP WB实验证实了14-3-3γ与ENDOG的相互作用。免疫荧光染色表明14-3-3γ与ENDOG共定位。
ENDOG是否影响14-3-3γ与其他自噬相关蛋白的相互作用呢?CoIP实验发现,ENDOG的过表达抑制了TSC2/Vps34和14-3-3γ之间的相互作用(图3i)。IP WB实验还表明,饥饿处理略微增强了ENDOG和14-3-3γ之间的内源性相互作用,而削弱了TSC2/Vps34与14-3-3γ的相互作用(图3j)。过表达14-3-3γ能重新激活mTOR途径,减少LC3B-II的积累和SQSTM1的降解,并减少ENDOG过表达细胞中自噬体的形成(图3k–m)。这些结果表明,ENDOG与14-3-3γ竞争性结合,使14-3-3γ释放TSC2(mTOR的负调节因子)和Vps34,抑制mTOR通路并启动自噬。
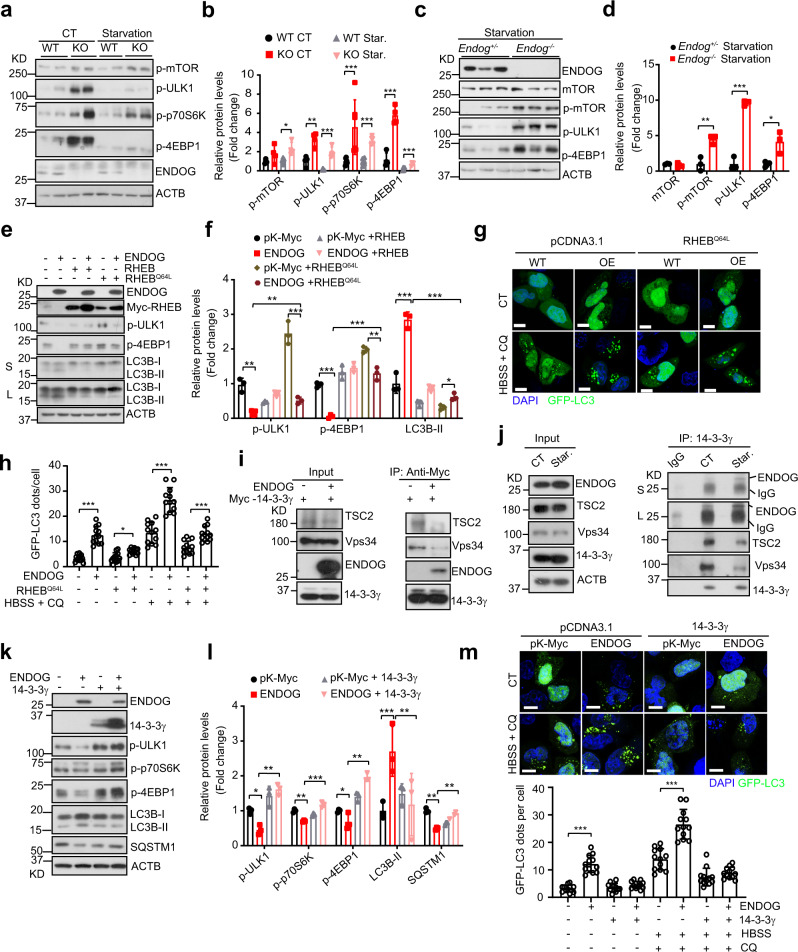
图3
5、GSK-3β介导的ENDOG磷酸化增强了其与14-3-3γ的相互作用
已知14-3-3蛋白主要通过与靶蛋白的一般共有序列RXXpS/TXP结合而起磷酸化作用,预测发现ENDOG的T128和S288磷酸化可能分别与14-3-3γ的S59和E18形成氢键。因此,将ENDOG的T128和S288进行突变,T128/S288变为A128/A288、T128/S288变为D128/D288,以模拟非活性(AA)和活性形式(DD)。Co IP结果表明AA形式抑制了ENDOG和14-3-3γ之间的相互作用,DD形式增强了这种相互作用(图4a,b)。而单独的突变对它们的相互作用没有影响。与野生型ENDOG和ENDOG-DD相比,ENDOG-AA在BafA1处理下的自噬体数量和LC3B-II积累较少(图4c、d),且不能再抑制mTOR通路来促进LC3B-II积累和SQSTM1降解(图4e,f)。此外,ENDOG在T128和S288的双重磷酸化对于其与14-3-3γ的相互作用和自噬的诱导是必要的。
预测发现激酶AKT和GSK-3β可能磷酸化ENDOG的T128和S288。然而实验表明,AKT过表达显著降低了ENDOG磷酸化,GSK-3β过表达显著增加了ENDOG磷酸化(图4g,h),增强了ENDOG和14-3-3γ之间的相互作用(图4g,h),但引入ENDOG的非活性形式(AA)后,这种作用被消除(图4i,j)。体外磷酸化实验也证实了GSK-3β磷酸化ENDOG(图4k)。

图4
6、ENDOG通过激活DNA损伤反应促进自噬
RHEBQ64L处理后ENDOG诱导的自噬仅部分恢复,推断ENDOG促进的自噬中可能存在额外的途径。DNA损伤反应是饥饿过程中的早期事件,由PARP-1/AMPK或ATM/CHK2途径介导,在自噬中起着重要作用。实验表明,ENDOG的缺失显著抑制了饥饿诱导的DNA损伤(图5a-e)。ENDOG敲除抑制了正常条件下PARP-1的表达和激活,阻断了饥饿诱导的AMPK激活和mTOR抑制(图5f,g),抑制了CHK1和CHK2的激活,从而抑制自噬(图5h,i)。结果表明ENDOG诱导的DNA损伤可能促进饥饿过程中的自噬。
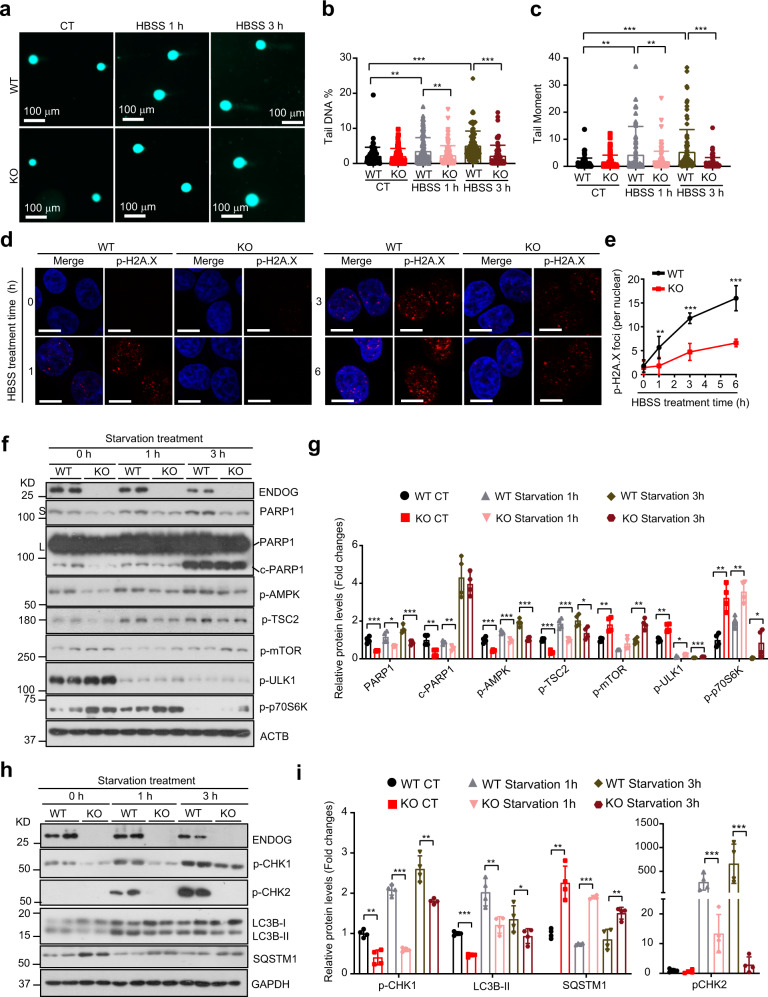
图5
那么阻断DNA损伤反应是否可以抑制ENDOG诱导的自噬呢?实验表明, ENDOG增强了依托泊苷诱导的DNA损伤(图6a-c)。同时,ENDOG敲除显著抑制了DNA损伤反应(增加了p-H2A.X和p-ATM表达)(图6d,e)。此外,依托泊苷处理的ENDOG敲除细胞的p-H2A.X显著减少,并且在恢复期p-H2A.X的减少更快(图6f,g)。这些数据表明ENDOG增强了DNA损伤反应。使用ATM特异性抑制剂KU-60019阻断DNA损伤反应后,ENDOG诱导的DNA损伤、LC3BII积累、p-H2A.X水平和自噬体的数量显著降低(图6h-k)。但在KU60019的处理下,ENDOG过表达细胞仍然具有更多的p-H2A.X。这些数据表明,ENDOG还可以通过激活DNA损伤反应来诱导自噬。
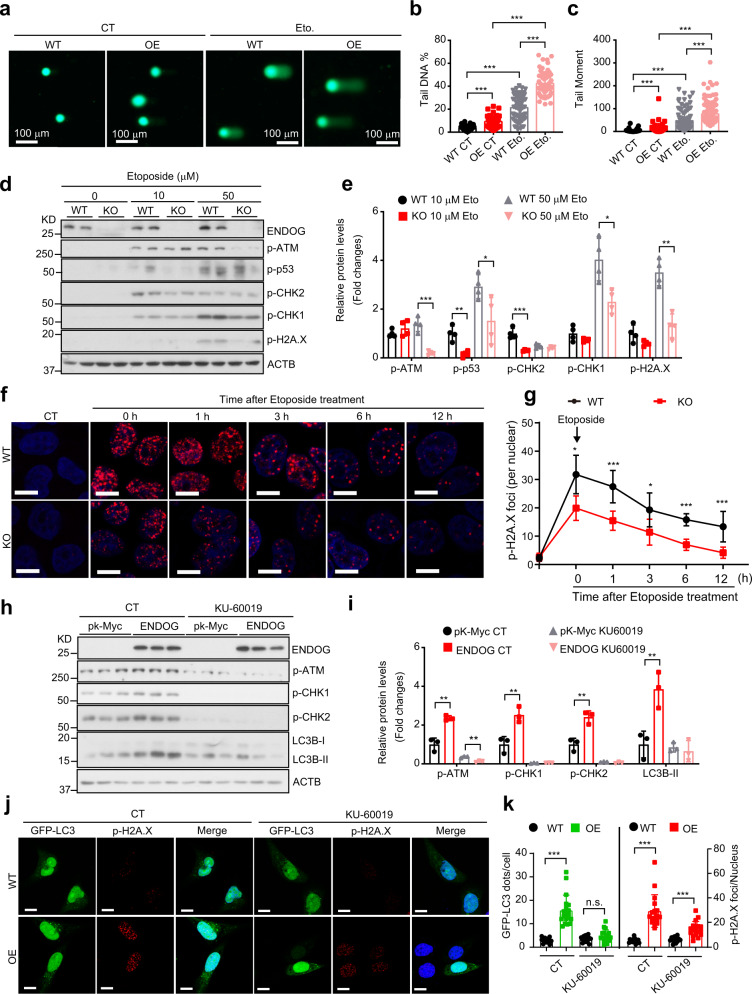
图6
6、ENDOG的核酸内切酶活性对自噬诱导至关重要
之后,研究者构建了各种突变体来确定ENDOG的哪个结构域对DNA损伤和自噬诱导至关重要(图7a),将这些突变体过表达到ENDOG敲除细胞中,并用依托泊苷处理。与野生型、Del 1-48(删除线粒体靶向序列)和ENDOG NLS(用核定位序列取代线粒体靶向序列)相比,EM ENDOG(突变氨基酸以消除其内切酶活性)过表达细胞中的p-mTOR、p-ULK1、p-p70S6K和SQSTM1表达更高,表明EM ENDOG失去了抑制mTOR活性和自噬促进的能力(图7b,c)。除了EM形式,野生型和这些突变体在ENDOG敲除细胞中的过表达都影响了自噬流(图7d、e)。彗星试验结果也进一步证实了ENDOG核酸内切酶活性对诱导的DNA损伤反应和自噬至关重要。
先前的研究表明,caspase-8可裂解并激活Bid,而Bid介导ENDOG从线粒体转移到细胞质,最终转位到细胞核,导致染色质凝聚和DNA断裂。为了探究caspase-8/Bid是否与本研究情况有关,研究者进一步试验发现,caspase-8/Bid有助于线粒体释放ENDOG,可能进一步促进自噬。

图7










 实验热线:4006991663
实验热线:4006991663











