多组氨酸标记蛋白占常规重组蛋白表达和纯化的 90% 以上。组氨酸标签与其他亲和标签相比具有许多优点,例如小尺寸、与 IMAC 树脂结合的高亲和力(固定金属亲和层析),并允许对重组蛋白进行一步纯化。 但有时组氨酸标记的蛋白质不会与亲和柱结合并逃避它的捕获和随后的纯化。 虽然这种情况并不常见,但无论何时发生都会令人非常沮丧。 但是,如果出现此类问题,有一些方法可以进行故障排除,辉骏生物下面将逐步讨论解决方案。
您的增溶缓冲液是否需要优化?
Ni-NTA 树脂对还原剂(如 DTT)和螯合剂(如 EDTA 或 EGTA)的存在很敏感,请确保增溶缓冲液中不含任何这些物质,因为它们会影响 IMAC 树脂的结合能力。
通常,蛋白质溶解/结合缓冲液中的咪唑浓度保持在 15-25 mM 以防止非特异性蛋白质与 IMAC 树脂结合,建议检查溶解缓冲液中的咪唑浓度,有时即使低咪唑浓度也可以防止结合将蛋白质转移到 Ni-NTA 树脂上 。 在这种情况下,应仔细尝试较低的浓度,以免干扰蛋白质与亲和树脂的结合。 另一个关键因素是增溶缓冲液的 pH 值。 当增溶缓冲液的 pH 值较低时,会导致组氨酸侧链质子化,这会阻止组氨酸残基与成功结合所需的金属配位。 通常建议保持缓冲液的 pH 值接近蛋白质的等电点。 添加咪唑会降低 pH 值,因此建议在添加咪唑后调节结合/增溶缓冲液的 pH 值。
您的亲和树脂新鲜有效吗?
为确保亲和树脂正常工作,请在同一缓冲液中对带有 His 标签的对照蛋白(之前已使用 IMAC 纯化过的蛋白)与感兴趣的蛋白质进行批量结合。 如果对照蛋白质与咪唑结合并洗脱,但您的目标蛋白质继续出现在流通和柱洗涤中并且没有洗脱,则是时候认真起来寻找其他原因了。
首次尝试纯化新型蛋白质时,请始终使用新鲜的 Ni-NTA。
您的蛋白质是否隐藏了组氨酸标签?
某些蛋白质可以在折叠的天然结构中隐藏多组氨酸标签,从而阻止蛋白质与 IMAC 亲和柱的结合。 结果是 标签无法与金属(通常是镍或钴)协调。 标签的不可接近性可能是由于标签被隐藏在折叠蛋白质的三维构象中。 一种快速而可靠的方法是在溶解缓冲液中存在强变性剂(如尿素或氯化胍)的情况下进行纯化。 尿素和氯化胍都是强大的变性剂,会使蛋白质展开,如果蛋白质在这些变性剂存在的情况下与树脂结合,则可以肯定地说折叠的蛋白质隐藏了他的标签并阻止了它与 IMAC 树脂的结合。
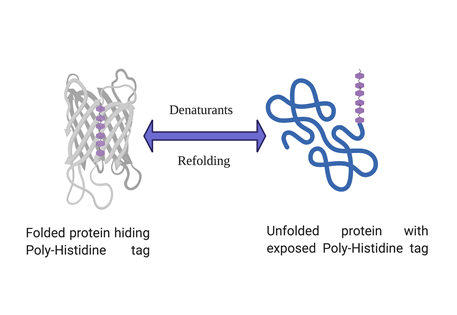
如何克服它?
克服隐藏组氨酸标签问题的方法有很多,其中一些方法如下:
1、在变性条件下纯化蛋白质,稍后再折叠。
2、添加接头序列以将蛋白质与聚组氨酸标签与蛋白质分开,通常可以使用聚丝氨酸或聚甘氨酸的接头。 该策略要求在克隆步骤进行干预。灵活接头的存在确保多组氨酸标签仍可用于与 IMAC 树脂结合,并且不会被蛋白质隐藏。
3、最后的选择是将 poly-His 标签放在相反的末端,看看这样的交换是否允许 His 标签绑定到亲和矩阵。
通常这些策略之一会起作用,但如果它们仍然不起作用,那么可以使用更大的亲和标签,例如 GST 或 MBP,而不是小的组氨酸标签。









 实验热线:4006991663
实验热线:4006991663



