RNA结合蛋白(RNA binding protein,RBP)是一类功能强大而广泛的调节因子,约占细胞编码的所有蛋白的5%-10%。目前除了少数RNA以核酶形式单独发挥功能,大部分RNA通过与蛋白结合形成RNA-蛋白复合物来发挥作用。
目前研究RNA-蛋白质相互作用的方法分为两大类:一是以感兴趣的RNA为中心,寻找与该RNA结合的蛋白质;二是以感兴趣的蛋白质为中心,寻找与该蛋白质结合的RNA。RNA pulldown属于前者,通过体外转录的方式将感兴趣的RNA带上标签,通过该标签使RNA结合到树脂支持物上,再加入样本蛋白质与RNA结合,洗涤、洗脱得到与目标RNA结合的蛋白质。
由于RNA pull down、RIP-Seq这些技术主要是用于筛选的,因此后续一般也要通过WB、PCR或者qPCR等进行验证。
RNA pull down是体外条件下寻找目标RNA的结合蛋白的方法。使用体外转录法标记生物素RNA探针,将体外转录的RNA结合到Beads上,再将RNA-Beads和细胞裂解液孵育,这样与目标RNA结合的蛋白便会一起吸附在Beads上。
洗涤掉不结合的蛋白后,用洗脱液将RNA-蛋白复合物从Beads洗脱下来,即RNA pull-down产物。该复合物可与链霉亲和素标记的磁珠结合,从而与孵育液中的其他成分分离。
这种互作复合物既可以用Western Blot检测特定的结合蛋白,还可以采用质谱方法鉴定与目标RNA结合的未知蛋白。
实验大致流程:RNA探针制备→总蛋白提取→磁珠预处理→RNA PullDown(磁珠-RNA探针复合物富集互作的蛋白)→蛋白洗脱→WB检测是否存在靶蛋白/质谱鉴定洗脱液中的蛋白
1 RNA探针制备
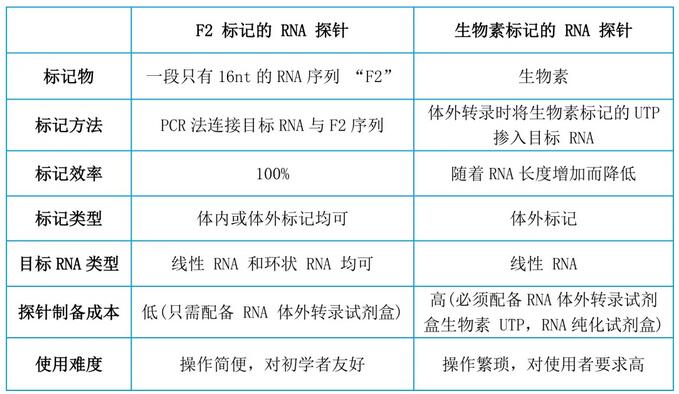
目前,体外RNA探针主要采用生物素标记,操作复杂且成本高。辉骏生物自主研发了一种用RNA标签“F2”来标记目标RNA探针的方法(已申请专利,已有文献引用),使标记更简单,成本更低。以下详细介绍下两种标记方法。
1.1 生物素标记的RNA探针制备
(1)构建RNA过表达质粒:基因合成+测序验证;
(2)体外转录模板准备:根据目标RNA序列设计带有T7启动子(TAATACGACTCACTATAGGG)的引物,以目标序列的DNA质粒为模板,PCR分别获得T7-正义RNA(实验组)和T7-反义RNA(对照组)转录模板,按照DNA凝胶回收试剂盒说明书要求回收纯化目标DNA;
(3)体外转录:以上述DNA为模板,加入相应的RNA体外转录配置的反应体系(含生物素UTPs),37℃孵育2 h,再加入1 μL DNase I,37℃孵育15 min将DNA模板消化,得到正义和反义RNA;
(4)为了避免转录产物中的游离生物素UTP 竞争结合磁珠,此处最好采用 RNA 纯化试剂盒来处理转录产物,但此操作可能造成一定的产物损失,可以根据具体情况决定是否进行此步操作;
(5)使用Nanodrop(紫外分光光度计)检测RNA浓度,取1-2 μL RNA进行2%琼脂糖凝胶电泳检测RNA质量和长度;符合要求的 RNA 置于- 80℃保存或直接用于后续实验。
1.2 F2标记的RNA探针制备
(1)操作方法与生物素标记的RNA探针类似,但在制备DNA模板时,需要将17bp的F2序列一起加入到引物中。RNA体外转录体系则无需再加入生物素UTPs,节省了成本,后续也不需要进行RNA纯化操作,简化了操作步骤。
(2)以上述DNA为模板,加入相应的RNA体外转录配置的反应体系(无需再加生物素UTPs),37℃孵育2 h,再加入1 μL DNase I,37℃孵育15 min 将DNA模板消化,得到正义和反义RNA。
图2 F2标记的RNA探针与生物素标记的RNA探针对比图1️⃣由于RNA容易降解,最好在RNA pull-down实验当天或前一天进行体外转录实验;2️⃣当目标序列过短(<300bp)或过长(>4kb)时,探针制备难度将增加;长序列可以分段进行实验。
2 总蛋白提取
2.1 细胞样本
(1)培养目标细胞,待细胞生长至合适密度,收集细胞;
(2)用预冷PBS缓冲液清洗细胞2-3次,加入0.6-1 mL预冷的裂解缓冲液(辉骏货号:FI8101),在裂解液中预先加入6-10 μL蛋白酶抑制剂(辉骏货号:FI8105)、3-5 μL RNA酶抑制剂(辉骏货号:FI8106),现用现配;
(3)4℃混匀仪上裂解30 min或者冰上超声至溶液基本澄清(如果无超声条件,可置于冰上裂解30 min,期间每10 min涡旋混匀一次,每次5 s);
(4)4℃离心机12000 rpm离心15 min,收集上清至新的1.5 mL无RNase EP管中;
(5)取30 μL作为input,剩余上清平分为两份用于RNA pull-down实验(记为实验组和对照组),置于冰上备用或-80℃保存。
2.2 组织样本
(1)采用预冷的PBS清洗新鲜组织,去除血液等成分;
(2)实验组和对照组分别取0.2-0.4 g干净的组织,用液氮在研钵中充分研磨,随后转移至预冷的无RNase、新的EP管中;
(3)将样本置于冰上,加入0.6-1 mL预冷的裂解缓冲液,在裂解液中预先加入6-10 μL蛋白酶抑制剂、3-5 μL RNA酶抑制剂,吹打混匀,现用现配;
(4)4℃混匀仪上裂解30 min或者冰上超声至溶液基本澄清;
(5)4℃离心机12000 rpm离心15 min,收集上清至新的1.5 mL无RNase EP管中;
(6)取30 μL作为input,剩余上清平分为两份用于RNA pull-down实验(记为实验组和对照组),置于冰上备用或- 80℃保存。
3 磁珠预处理
(1) 将链霉亲和素磁珠(辉骏货号:FI8303)上下颠倒混匀,取实验组和对照组一共所需的80 μL 磁珠到新的无RNase EP管中;
(2) 加入1 mL NT2缓冲液,颠倒混匀30次,放磁力架上静置1 min 并弃上清;
(3) 重复上步操作一次;
(4) 加入400 μL NT2缓冲液,上下颠倒重悬磁珠;
(5) 将磁珠平分为两份,每组各约200 μL,转移到新的无 RNase EP管中,记为实验组和对照组。
4 RNA pull-down
(1) 取实验组和对照组RNA探针各3 μg,95℃加热变性3 min,冰浴1 min,瞬离,向管中加入50 μL RNA结构缓冲液,室温放置30 min;
(2) 将RNA探针分别加入对应的磁珠中,混匀仪上室温孵育30 min;
(3) 放磁力架上静置1 min,并弃上清;
(4) 每组加入500 μL漂洗液,颠倒混匀30次,放磁力架上静置1 min,并弃上清;
(5) 重复上步操作一次;
(6) 加入相应组别的样本裂解液,混匀仪上4℃孵育2~4 h;
(7) 放磁力架上静置1 min 并弃上清;
(8) 每组加入 500 μL 漂洗液,颠倒混匀30次,放磁力架上静置1 min 并弃上清;
(9) 重复上步漂洗操作两次,共漂洗三次,保留磁珠。
5 蛋白洗脱
5.1 变性洗脱
(1)向磁珠中加入50 μL 1×SDS-PAGE上样缓冲液进行洗脱,振荡混匀后瞬离,95℃加热5-10 min;
(2)放磁力架静置1 min,收集上清至新的1.5 mL EP管中,进行SDS-PAGE或Western Blot检测,如果需要进行质谱检测,则切胶条后送检。
5.2 非变性洗脱
(1)向磁珠中加入50 µL洗脱缓冲液(辉骏货号为:FI8102),涡旋振荡20 s,放混匀仪上室温洗脱10-15 min,涡旋振荡20 s;
(2)1000 g离心20 s,放磁力架上静置1 min,收集上清至新的1.5 mL EP管中;
(3)洗脱后的蛋白-80℃保存,或直接用于SDS-PAGE、Western Blot和质谱等实验。
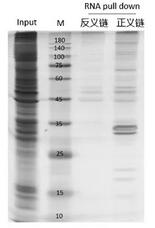
1️⃣如果选择非变性洗脱法,可以暂时保留洗脱后的磁珠,当非变性洗脱效率较低时,则采用变性洗脱法继续洗脱蛋白。2️⃣RNA pull-down捕获的蛋白量通常较少,因此SDS-PAGE胶建议用硝酸银染色,检测富集蛋白的情况。
6 WB检测是否存在靶蛋白/质谱鉴定洗脱液中的蛋白
6.1 WB检测是否存在靶蛋白
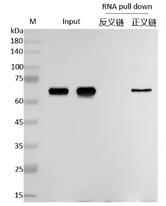
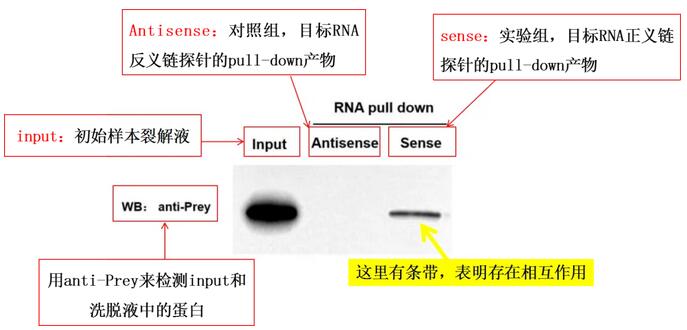
通过蛋白印迹(Western Blot)技术使用Anti-Prey对沉淀中的蛋白质进行检测,若能够检测在目标RNA沉淀中有清晰Prey条带,则说明存在特异性相互作用。
图4 RNA pull down WB检测图(阳性)6.2 质谱鉴定洗脱液中的蛋白
通过质谱鉴定实验组与对照组的差异蛋白,进而筛选可能的互作蛋白。
图5 RNA pull down MS产物银染胶图
Input组(阳性对照组):样本裂解液;
Antisense(对照组):目标RNA反义链探针的pull-down产物;
Sense(实验组):目标RNA正义链探针的pull-down产物。
先看Input组:验证Input组需检测到待测蛋白(Prey)条带。若Input组无信号,说明样本中待测蛋白未提取成功或浓度过低,后续Sense组和 Antisense组的结果无意义,需重新优化蛋白提取步骤。
再比较Sense组与Antisense组:判断特异性相互作用。若Sense组检测到待测蛋白(Prey)条带,且Antisense组无条带或条带极弱,说明目标RNA正义链能特异性结合待测蛋白,可判定二者存在相互作用。
RNA pulldown实验验证目标RNA与待测蛋白(Prey)是否存在相互作用,如果最终的结果Sense组有条带,则可以证明之间存在相互关系。上图为RNA pull-down阳性结果示意图:表明目标RNA可以与Prey蛋白结合,存在相互作用。
✅注意:
1️⃣如果Sense组与Antisense组均检测到明显的待测蛋白信号:说明存在非特异性结合(如探针与蛋白的非特异吸附),需优化实验条件(如增加洗涤次数、调整探针浓度、用5%BSA封闭磁珠)后重新验证。2️⃣如果Sense组与Antisense组均未检测到待测蛋白信号:需先确认Input组是否有信号,若Input组有信号则可能是探针与蛋白结合效率低(如探针标记失败、孵育条件不当),需排查探针制备或孵育步骤。
1 RNA pull down试剂盒
2 RNA pull down实验服务
如果您在做RNA pulldown实验上还有疑问,欢迎咨询我们的技术人员:400-699-1663。
辉骏生物还提供各种类型蛋白互作试剂盒以及互作实验服务(IP、RIP、RNA pull down、ChIP、DNA pull down实验),可根据实验需求定进行选择,助力您的科研更高效、更精准!











 实验热线:4006991663
实验热线:4006991663