GST pull-down是体外验证蛋白直接互作的核心技术,实验设计尤其是对照组设置是实验难点。该实验易受非特异性结合、GST标签自吸附干扰,严谨对照是排除干扰、满足论文审稿要求的关键。辉骏生物将从实验原理、对照设计、实验流程、文献应用;四方面详解GST pull down。
GST pull-down是什么?
GST pulldown 利用标签‑配体的亲和作用,在体外纯化带标签的目的蛋白,与裂解液孵育形成互作复合物,再通过亲和介质富集该复合物。
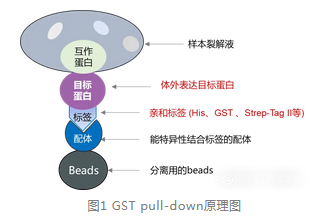
GST pull-down
注意:特别适用于强互作蛋白,也很适合研究蛋白间的直接相互作用。
GST pull-down实验对照
实验组为GST‑X融合蛋白,对照组为GST空载体蛋白。
各取菌体裂解液作为Input,检测蛋白表达与条带位置,
两组在相同条件下与含His‑Y的裂解液孵育。
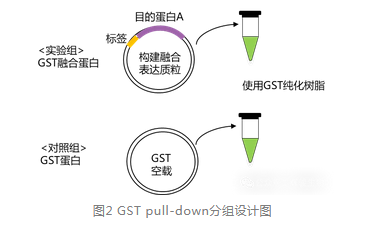
对照组(阴性对照)—GST蛋白
目的:表达GST空载蛋白与His-Y蛋白待测样本,采用GST纯化树脂(辉骏货号:FI8304)进行pulldown实验,目的是为了排除GST 标签自身与诱饵蛋白的非特异性结合,避免因标签干扰造成的假阳性结果。
实验组—GST-X融合蛋白
目的:表达GST-X融合蛋白与His-Y蛋白待测样本,采用GST纯化树脂进行pull-down实验,检测其与待测蛋白之间的特异性相互作用,明确两种蛋白是否存在结合关系。
可选对照:流穿液检测
目的:收集与GST纯化树脂孵育后的上清液,通过蛋白定量或电泳检测,评估GST融合靶蛋白的富集效率,判断实验体系的有效性。
利用GST标签与GST纯化树脂的特异性结合作用,捕获样本中的GST-X融合蛋白,筛选与之结合的互作蛋白,或验证待测蛋白(His-Y)是否与X存在直接相互作用。
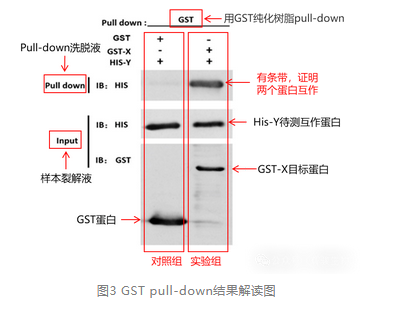
结果图中 “+” 为加该蛋白,“-” 为不加。Input 均有条带,说明蛋白表达正常。若 pull‑down 洗脱液出现 His‑Y 条带,即证明 GST‑X 与 His‑Y 存在直接相互作用。
GST pull-down实验流程
实验流程:GST诱饵蛋白诱导表达、制备纯化,待测样本制备后进行GST pull down,最终用WB或质谱鉴定洗脱液蛋白。
体外表达带标签诱饵蛋白并纯化,与样本裂解液孵育,漂洗去未结合蛋白后洗脱,通过WB或质谱检测洗脱液中互作蛋白。
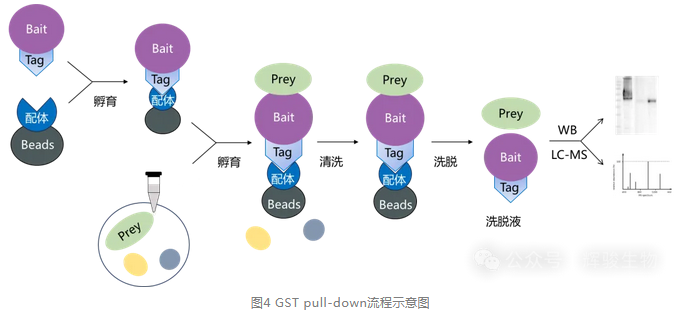
ps:辉骏生物自有质谱检测平台,擅长IP、pull-down产物等微量蛋白的质谱鉴定及生信分析
GST pull-down文献解读
1.GST pull-down验证蛋白是否存在直接相互作用
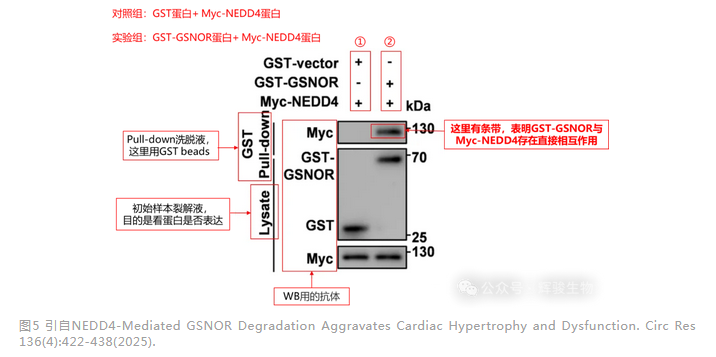
从图中可以看到Lysate(即Input组)所有转染组均出现对应蛋白条带,说明目的蛋白均成功表达,而且可以看到GSNOR蛋白加了GST-tag,比单纯的GST标签蛋白分子量要高很多。
泳道① GST-vector蛋白+Myc-NEDD4为对照组,泳道② GST-GSNOR蛋白+Myc-NEDD4为实验组。泳道①、②是利用GST-Pulldown拉下来的复合物,泳道②的GST-GSNOR蛋白能够下拉到His-CsATG8c蛋白,因此通过GST pull-down证明了GST-GSNOR蛋白与Myc-NEDD4蛋白存在直接相互作用。
2.GST pull-down验证两个蛋白结合的结构域
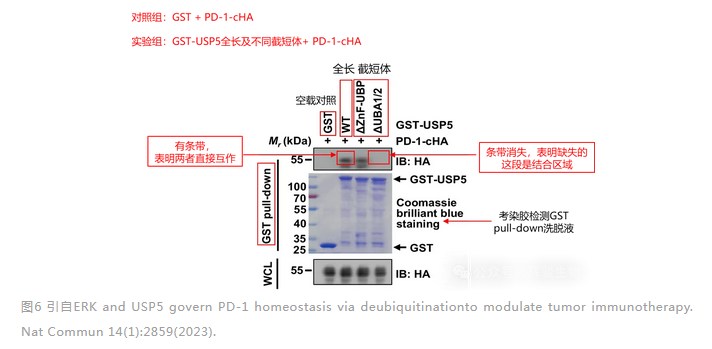
对照组用的是GST空载蛋白,实验组是GST-USP5融合蛋白的全长及不同截短体。从图中可以看到WCL(即Input组)检测到HA蛋白条带,从银染胶上也可以看到纯化后GST蛋白和GST-USP5融合蛋白的全长和截短体条带,说明蛋白均成功表达。
就可以往下看pull down,这里是用GST纯化树脂进行pull-down,发现GST-USP5全长能够富集到HA蛋白条带,说明GST-USP5与PD-1-cHA蛋白存在直接相互作用。而缺失GST-USP5的UBA1/2这一段发现条带消失,说明GST-USP5的UBA1/2这一段是与PD-1-cHA蛋白结合区域。
辉骏生物GST pull-down试剂盒—客户应用案例
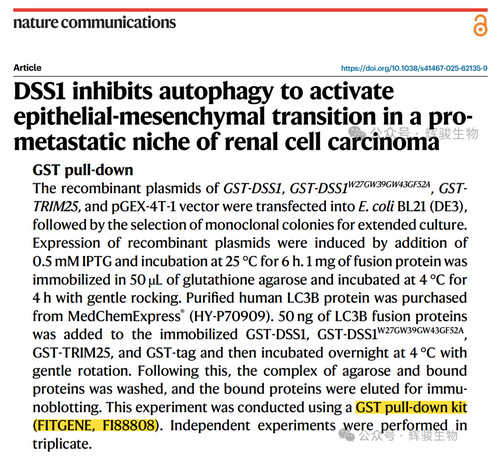
2025年7月23日,重医基础医学院赵明明/宋晶团队在Nature Communications发表论文,探讨了DSS1在ccRCC转移中的关键作用及分子机制,为其治疗提供新思路。
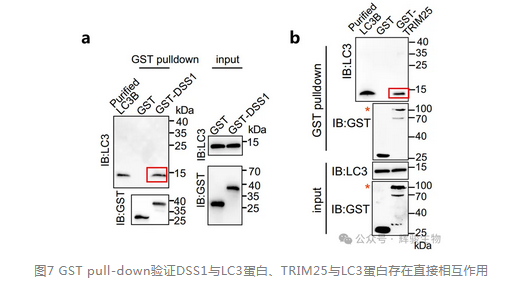
作者通过GST pull down实验(由辉骏生物提供试剂盒)进行DSS1与LC3蛋白、TRIM25与LC3蛋白相互作用验证,发现DSS1与LC3蛋白,TRIM25与LC3蛋白均存在直接相互作用(详见图1a、b)。
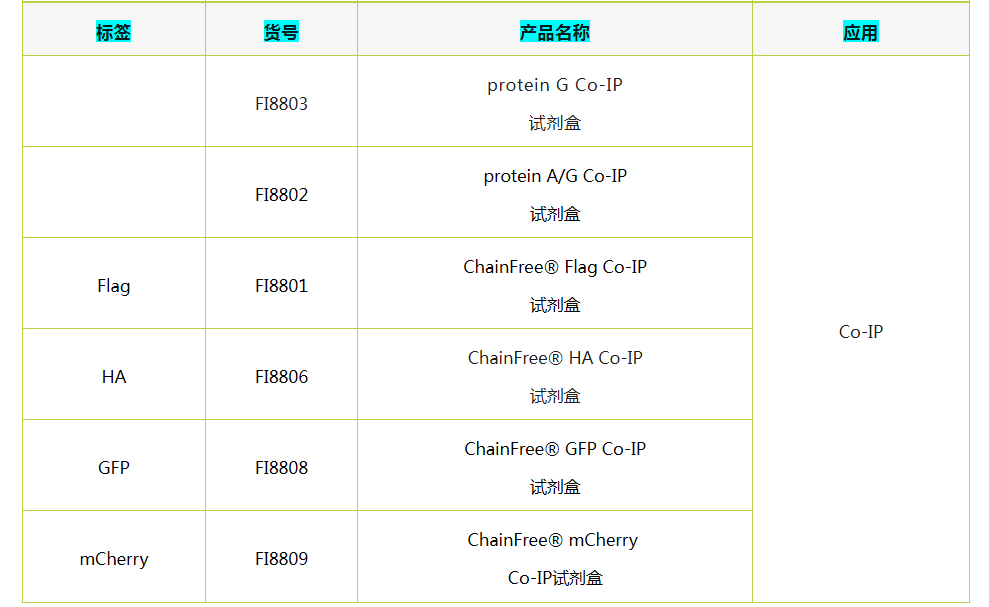
辉骏生物纳米抗体磁珠及IP试剂盒

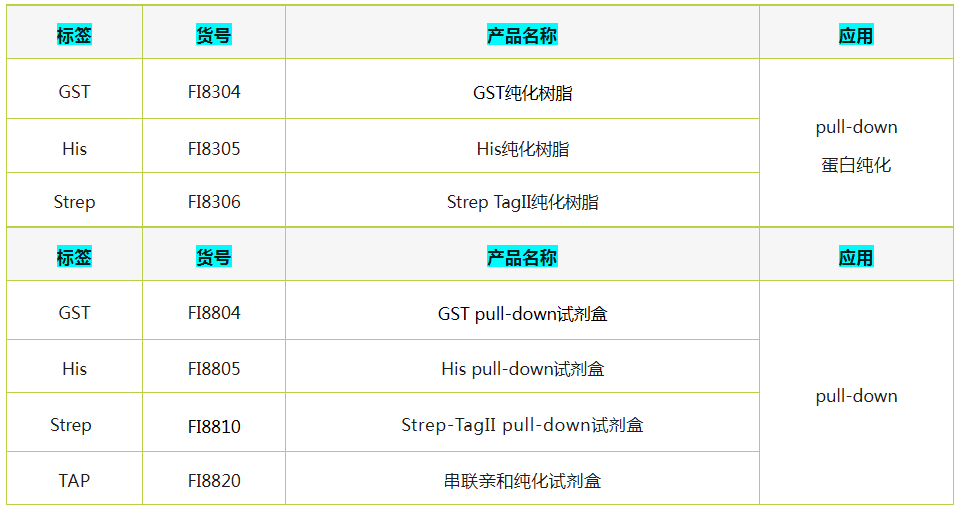
辉骏生物pull-down纯化树脂及试剂盒










 实验热线:4006991663
实验热线:4006991663














