中文标题:lPRMT1介导的UBAP2L精氨酸甲基化调控应激颗粒组装
发表期刊:Cell Death & Differentiation
影响因子:12.067
发表时间:2020年
合作单位:南方医科大学
运用技术:LC-MS/MS蛋白质谱鉴定(由辉骏生物提供技术支持,点击查看服务详情)
● 研究背景
应激颗粒(SG)是真核细胞遇到环境胁迫时形成的停滞信使核糖核蛋白复合体(MRNP)的离散集合。RNA结合蛋白(RBP)通过招募mRNP群体来调节它们的凝聚。然而,有关泛素相关蛋白2样蛋白(UBAP2L)在SG动态调控中的细胞和分子机制仍不清楚。
● 研究结果
1. UBAP2L参与SG组装
研究者将FLAG-UBAP2L或FLAG空载体转染HEK293细胞,用FLAG一抗进行Co-IP。质谱法分析FLAG-UBAP2L组和FLAG组之间的差异条带。其中3个沉淀蛋白被鉴定为脆性X智力低下综合征相关蛋白2(FXR2)、FXR1和ras GTPase激活蛋白结合蛋白2(G3BP2)(图1A)。互作实验表明UBAP2L与FXR1、FXR2和G3BP2相互作用(图1B-D)。由于FXR1、FXR2和G3BP2参与了SG的形成,研究者进一步调查了UBAP2L是否也参与了这一细胞过程。用5种不同的SG诱导剂刺激HeLa细胞,对UBAP2L及其结合伙伴G3BP或FXR1进行联合IF分析,以确定UBAP2L在不同应激条件下参与SG的情况。结果表明UBAP2L不参与克霉唑(CZ)诱导的SG(图1E)。在HeLa细胞中UBAP2L和FXR1的Co-IF分析中也得到了类似的结果(图1F)。这些结果表明,UBAP2L参与了多种化学物质诱导的SG的形成。

图1
2. UBAP2L调节SG动态
通过G3BP和eIF4G(另一个典型的SG成分)作为标记(图2A、C和E),敲除UBAP2L后,AS、H2O2和山梨醇诱导的SG的形成显著减少。此外,在UBAP2L基因敲除后,去除AS后SG的检测率略高于应激组,这表明UBAP2L基因敲除延缓了SG的降解。这些结果表明,UBAP2L基因敲除不仅抑制了应激诱导的SG组装,而且延缓了应力消除后SG的拆解。UBAP2L过表达促进了H2O2诱导的SG组装,NC组和RNAi组在去除H2O2后SG的形成都显示出2倍以上的增加(图2B,D和E)。这些结果表明,UBAP2L是SG动力学的关键调节器,是SG组装和拆卸所必需的。

图2
3. UBAP2L对SG核仁与40S核糖体亚基相互作用的影响
接下来,研究者探究了UBAP2L介导SG组装的机制。WB分析显示,无论在有无应激刺激的情况下,UBAP2L蛋白水平都保持相对稳定(图3A)。此外,UBAP2L敲除(图3B)或过表达(图3C)都并没有改变其他SG蛋白的蛋白质水平。这表明UBAP2L介导的SG动态调控不涉及UBAP2L本身或其他SG蛋白表达的变化。因此,研究者探究了UBAP2L影响SG核蛋白或40S核糖体亚基[例如核糖体蛋白(RP)S6]之间的相互作用。结果显示,在正常和AS条件下,UBAP2L基因敲除抑制了G3BP2与PABPC1或RPS6之间的相互作用(图3D)。加入RNaseA后,G3BP2与PABPC1的结合减弱,而与RPS6的结合增强,UBAP2L基因敲除后G3BP2与PABPC1的结合也减弱。这些结果表明,UBAP2L影响SG核仁与40S核糖体亚基之间的相互作用,提示着UBAP2L调控SG动态的机制。
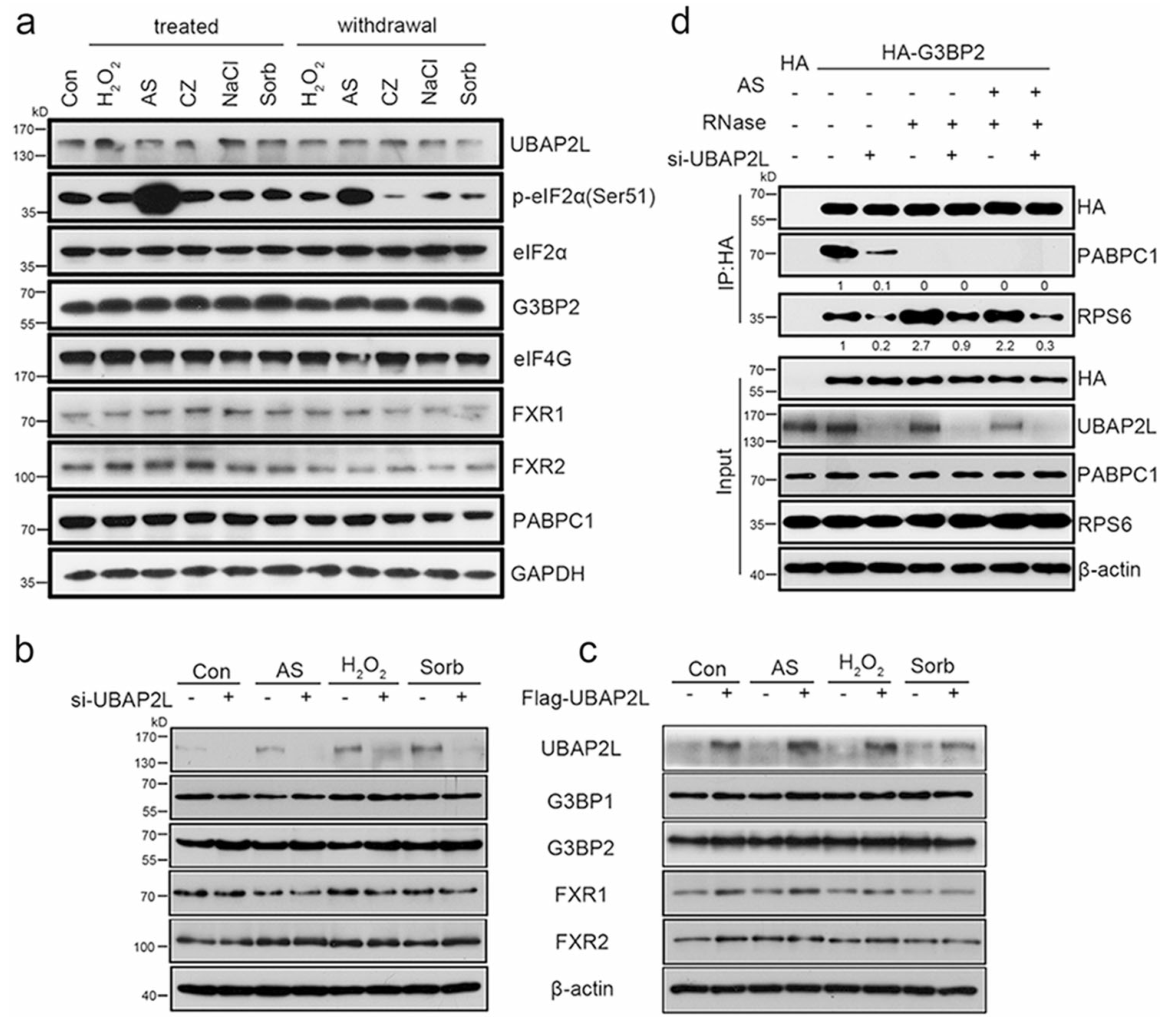
图3
4. SG组装需要UBAP2L中的RGG基序
UBAP2L包含一个UBA结构域,一个RGG基序,三个具有预测mRNA结合活性的区域,以及一个未知功能域。这些特征赋予了UBAP2L成核SG形成的能力。因此,我们检测到UBAP2L与其他已知的SG核蛋白或核糖体亚基的潜在联系。结果显示,UBAP2L在正常条件下与G3BP1、G3BP2和PABPC1结合,这些相互作用在AS处理后略有下降。UBAP2L与核酸体的结合是RNA依赖性的,因为它们的结合在RNase处理后完全消失,而它对核糖体解离的EDTA-EGTA(EE)或稳定核糖体的Mg2+具有抗性。正常情况下,UBAP2L与小的40S亚基蛋白RPS6结合,而不与大的60S亚基RPL4结合,表明UBAP2L优先与40S亚基结合,而不是60S核糖体亚基。UBAP2L直接与EE解离的40S和60S亚基中的RPS结合,而在Mg2+稳定的完整80S核糖体中不能与RPS结合,但不与亚基中的rRNA结合。为了进一步定位UBAP2L中负责这些关联的结构域,用标记的UBAP2L-野生型(WT)或缺失体转染HEK293细胞,Co-IP/WB分析UBAP2L缺失与SG蛋白的相关性。结果表明,RGG基序是UBAP2L通过招募其他核因子和核糖体亚基形成SG所普遍需要的,而DUF结构域介导了UBAP2L和G3BP之间的分子相互作用,从而协同促进了SG的成核。接下来,研究者探究了每个结构域在具有稳定UBAP2L下调的HeLa细胞中SG凝聚中的作用。结果表明,在正常条件下,UBAP2L-WT的瞬时过表达诱导了SG的形成,这表明UBAP2L的过表达导致了SG的成核。UBAP2L RGG在正常情况下显示出散在的胞浆定位,并在AS处理后完全排除在G3BP2组装之外(图4C,D),这证实了RGG基序在UBAP2L SG能力中的重要作用。DUF结构域的缺失导致UBAP2L从细胞质穿梭到细胞核(图4C),表明去除DUF结构域增加了核UBAP2L水平,降低了UBAP2L细胞质表达。研究者还观察到G3BP1/2的适度胞质-细胞核易位(图4E)。然而,在G3BP1/2双敲除后没有观察到这种UBAP2L核转位(图4F),UBAP2L基因敲除也未能诱导G3BP移位到细胞核中(图2A),表明UBAP2L表达并不负责将G3BP保留在细胞质中,而DUF结构域充当了这一角色。
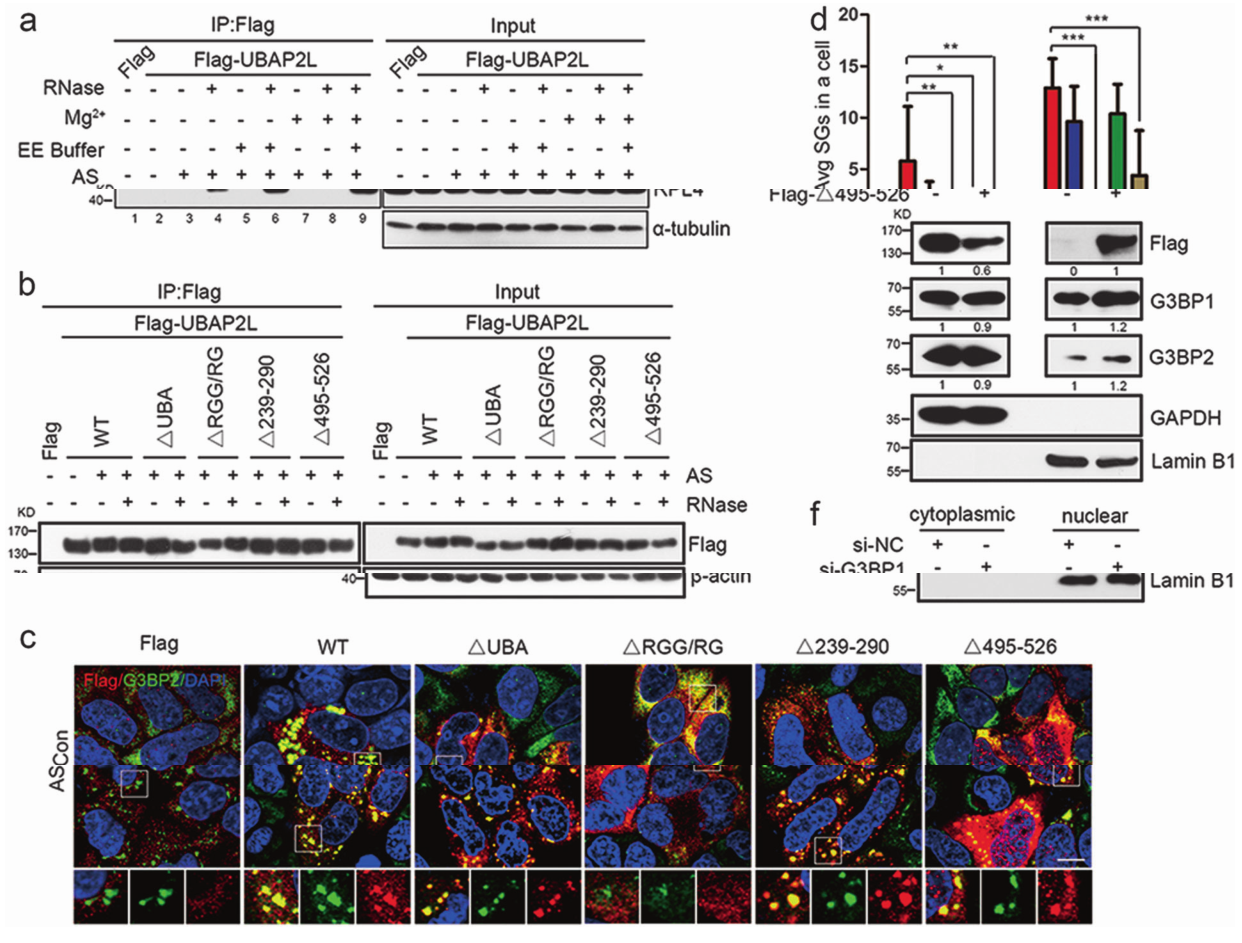
图4
5. UBAP2L中的RGG基序被PRMT1不对称地甲基化
Co-IP/MS分析还确定了UBAP2L的另一个相互作用伙伴,PRMT1(图5A,B)。体外甲基化试验表明,UBAP2L被PRMT1二甲基化(图5C)。RGG结构域的缺失取消了UBAP2L与PRMT1的相互作用以及ADMA信号,而UBA结构域的删除显著地加强了他们之间的联系(图5D)。这些结果表明,UBAP2L中的RGG基序是PRMT1的独特靶区。为了证实RGG基序中的精氨酸残基被PRMT1甲基化,研究者特别设计了UBAP2L结构,其中RGG基序中的所有精氨酸残基都突变为丙氨酸(UBAP2L-R131-190A)或赖氨酸(UBAP2L-R131-190K),丙氨酸取代被用来测试精氨酸残基的生物学作用,而赖氨酸取代被用来测试不对称二甲基官能团的作用。结果表明,PRMT1只针对UBAP2LWT,而不是UBAP2L-R131-190A或UBAP2L-R131-190K突变体(图5e),AS处理降低了UBAP2L-WT与PRMT1的相互作用,以及ADMA水平(图5e),表明胁迫降低了UBAP2L甲基化。接下来研究者评估了精氨酸甲基化和SG形成之间的关系,UBAP2L-R131-190K与UBAP2L-WT的SG能力相当,而UBAP2L-R131-190A则显示出明显的SG缺乏(图5F,G)。然而,在正常或胁迫条件下,SG的形成都没有明显的变化(图5H和I),仍然检测到PRMT1结合和ADMA信号(图5J)。这些数据表明,UBAP2L中的RGG基序被PRMT1不对称地甲基化。

图5
6. UBAP2L中精氨酸甲基化减少促进SG组装
基于以上结果,研究者推测UBAP2L中精氨酸甲基化水平的降低促进了SG的组装。基因敲除实验显示,PRMT1敲除显著促进了UBAP2L-WT诱导的HeLa细胞中SG的形成,而PRMT1过表达则显著抑制了SG的形成。在用PAN甲基转移酶抑制剂腺苷二醛(ADOx)处理的细胞中,UBAP2L-WT组,而不是UBAP2L-R131-190K组,显示出比对照组明显更多的SG(图6A,B)。这表明UBAP2L精氨酸甲基化抑制了SG的组装,而它的减少促进了SG的组装。最后,研究者进行了应激恢复实验,以监测UBAP2L在整个治疗和恢复期的甲基化状态。随着压力增加,eIF2α磷酸化增加,随后在恢复后随时间降解(图6D),UBAP2L上的PRMT1结合和ADMA水平也均随着治疗降低。在恢复期间,UBAP2L由PRMT1逐渐与ADMA甲基化(图6D)。这表明,应激降低了UBAP2L甲基化,在应激恢复过程中,UBAP2L甲基化再次增加。这些结果表明,PRMT1是一个重要的分子开关,通过监测UBAP2L精氨酸甲基化在SG的动态调节中发挥作用。

图6









 实验热线:4006991663
实验热线:4006991663








