中文标题:lncRNA LAMP5-AS1调节白血病细胞干性
发表期刊:Journal of Hematology & Oncology
中科院分区:1区
影响因子:23.168
发表时间:2020年
合作单位:中山大学生命科学学院
运用技术:LC-MS/MS蛋白质谱鉴定(由辉骏生物提供技术支持,点击查看服务详情)
● 研究背景
混合系白血病(MLL)基因重排引发造血干/祖细胞异常的表观遗传修饰和基因表达,使其成为最具侵袭性的白血病亚型之一。MLL基因可以与60多个伙伴重组,直接抑制MLL重排本身显然是困难的。因此,了解MLL白血病细胞如何促进自我更新和阻滞分化的机制才能提供新的治疗策略。
● 研究结果
1. LAMP5-AS1是维持抗MLL白血病细胞分化的自我更新能力所必需的
LAMP5-AS1是起源于20号染色体上溶酶体相关膜蛋白5(LAMP5)编码基因反义链上的lncRNA。研究者在大量临床样本的分析中发现了LAMP5-AS1在MLL白血病中的高表达(图1A)。取4例MLL白血病患者骨髓进行原代细胞培养,其中包括3例急性淋巴细胞白血病和1例急性髓系白血病。LAMP5-AS1基因敲除后,原代细胞被显著诱导向淋巴细胞或单核/巨噬细胞分化(图1B),集落形成能力显著减弱(图1C),白血病干细胞和祖细胞的分化水平增加(图1D),细胞的增殖和自我更新能力严重受损(图1E),分化急剧增加(图1F)。这些结果表明,敲除LAMP5-AS1基因可显著抑制MLL白血病细胞的自我更新能力,促进其分化,提示着LAMP5-AS1基因在MLL白血病的发生发展中起着一定的作用。

图1
2. LAMP5-AS1促进MLL白血病进展
接着,研究者将转染shLAMP5-AS1的MOLM13细胞和对照细胞(sh-NC)注射到NOD/SCID小鼠尾静脉,建立了异种移植模型,进一步探究LAMP5-AS1在体内对MLL白血病发生过程的影响。H&E染色检测LAMP5-AS1基因敲除对小鼠脏器浸润的调节作用。结果显示,与sh-NC组小鼠相比,转染sh-LAMP5-AS1的小鼠骨髓、脾脏和肝脏中的MLL白血病细胞数量明显减少(图2A),器官浸润能力显著降低(图2B,C),分化标记CD11b、CD14(图2D,E)和显著的分叶状核型显著增加(图2F),小鼠存活时间更长(图2G),MOLM13细胞的自我更新频率显著降低(图2H)。这些结果表明,LAMP5-AS1是一种在MLL白血病中特异性高表达的lncRNA,对MLL白血病促进自我更新能力和抑制分化是必需的。
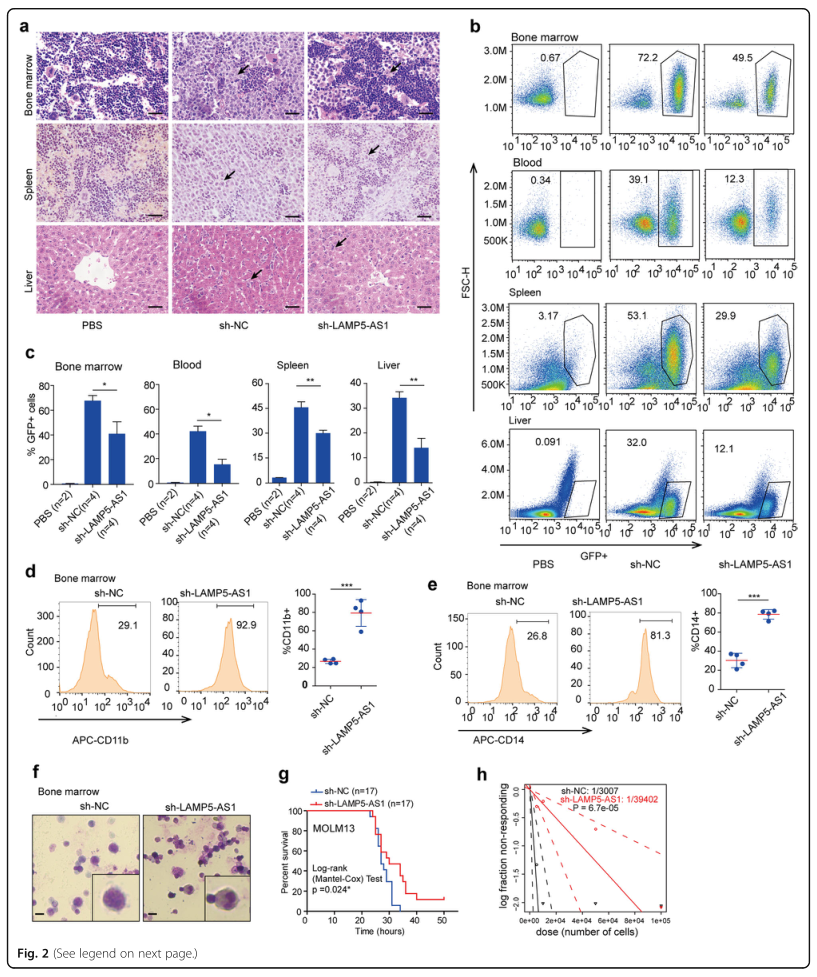
图2
3. LAMP5-AS1与H3K79甲基转移酶DOT1L在其催化区富含赖氨酸的区域直接结合
研究者通过RNA pull-down和质谱分析鉴定与LAMP5-AS1相互作用的蛋白质,其中组蛋白甲基转移酶DOT1L引起了研究者的兴趣,DOT1L被MLL融合蛋白招募,导致HOXA基因、MEIS1基因和其他基因的表观激活,在MLL白血病的发生发展中起着重要作用。为了验证LAMP5-AS1可能通过与DOT1L相互作用而发挥作用的这一假设,研究者先后通过RNA pull-down和RIP实验分别验证了二者之间的相互作用和这种相互作用的特异性(图3A,B)。为了进一步探究LAMP5-AS1是如何与DOT1L结合的,以及它是否有可能影响组蛋白甲基转移酶的功能,研究者接下来用DOT1L或LAMP5-AS1截断的突变体进行了实验。最终结果表明,LAMP5-AS1与DOT1L催化结构域的390-407aa区域(一个富含赖氨酸的区域,对于DOT1L(1-416aa)催化H3K79甲基化非常重要)特异性结合(图3D-I)。
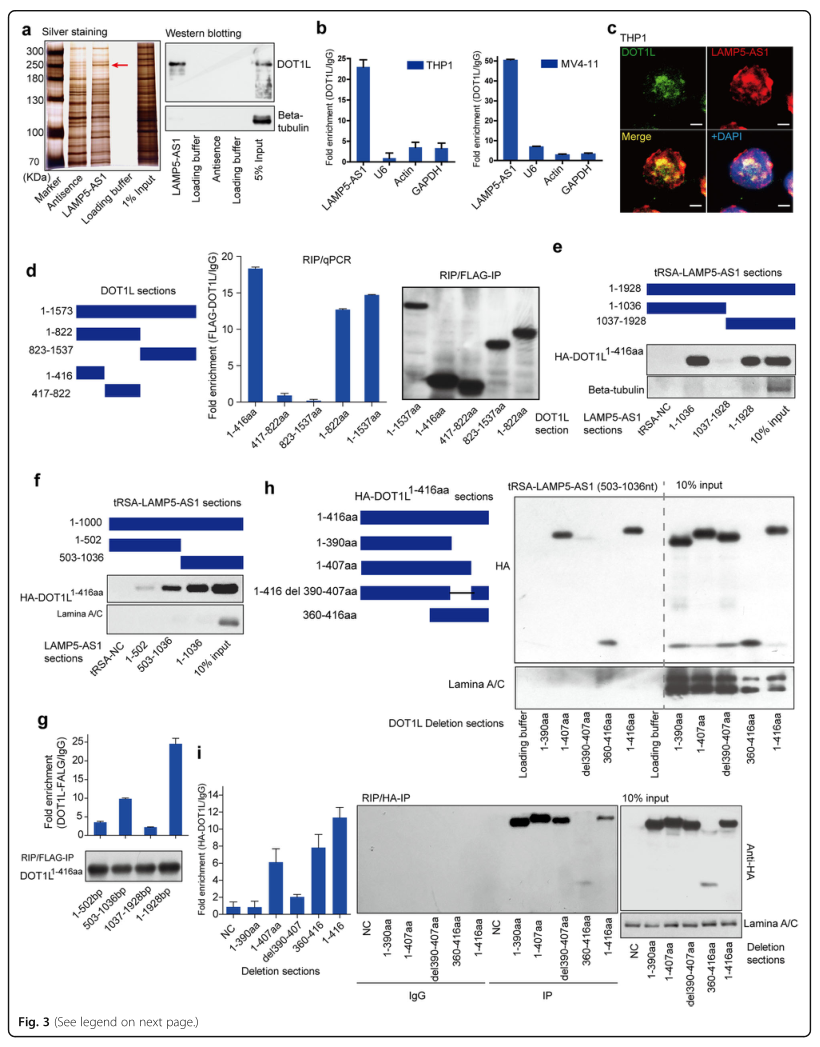
图3
4. LAMP5-AS1对DOT1L甲基转移酶活性的影响
接下来,研究者通过无细胞组蛋白甲基转移酶(HMTase)检测了LAMP5-AS1是否通过与其催化结构域的富含赖氨酸区结合而影响DOT1L甲基转移酶的活性。分别通过体外转录和原核表达系统获得了纯化的LAMP5-AS1和重组GST标记的1-416aa DOT1L(图4A,b),从HeLa细胞中分离的核小体,以及S-腺苷蛋氨酸用于HMTase分析(图4C)。结果发现,DOT1L-LAMP5-AS1复合物具有更高的甲基转移酶活性,且lncRNA具有刺激高阶H3K79甲基化的能力(图4D)。进一步进行电泳迁移率改变分析(EMSA),鉴定出了LAMP5-AS1(503-764nt)和DOT1L(1-416aa)之间的直接相互作用(图4E)。这些结果表明,LAMP5-AS1通过增强DOT1L的甲基转移酶活性来促进MLL白血病细胞的自我更新能力。
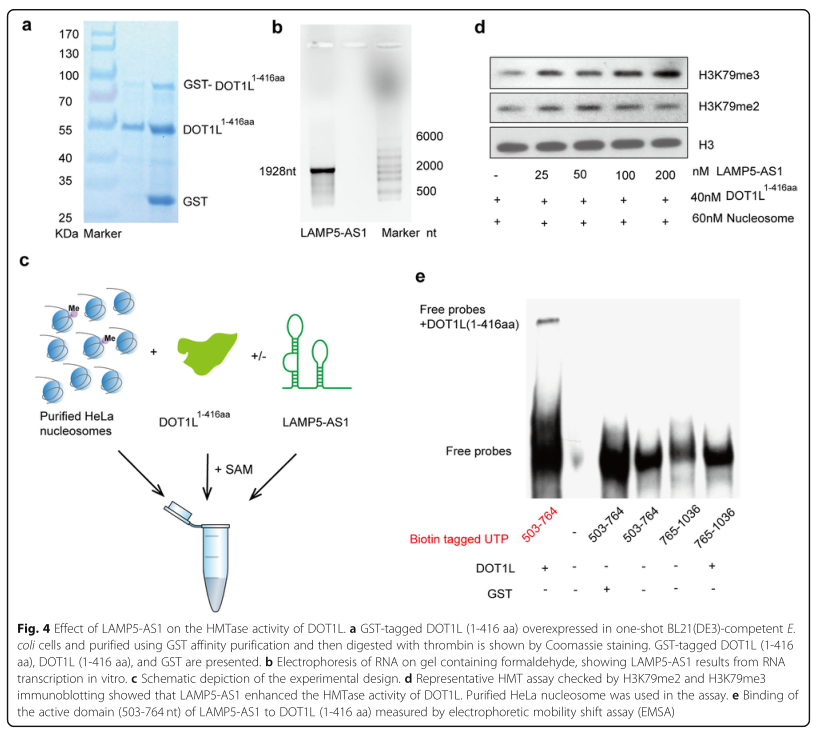
图4
5. LAMP5-AS1调控MLL融合蛋白靶基因H3K79me2/3的全局模式
鉴于LAMP5-AS1通过直接与N端催化结构域结合而促进DOT1L的甲基转移酶活性这一特点,研究者进行了一系列后续实验探究LAMP5-AS1是否能影响H3K79me2/3的全基因组水平。Western blotting分析显示,敲除LAMP5-AS1导致MOLM13细胞和原代MLL白血病细胞中H3K79me2和H3K79me3的水平显著降低(图5A,B),这表明LAMP5-AS1可能是H3K79甲基化状态较高的关键因素。ChIP分析证实了在LAMP5-AS1被沉默后,HOXA9、HOXA10和Meis1基因体上H3K79me2/3的下调(图5D-F)。研究者还进行了129个MLL-AF9靶基因的荟萃分析(图5G),和MLL融合蛋白核心靶基因的表达模式(图5H),最终结果表明,LAMP5-AS1通过上调H3K79me2/ME3和DOT1L异位靶基因转录促进MLL白血病细胞自我更新和阻滞分化。
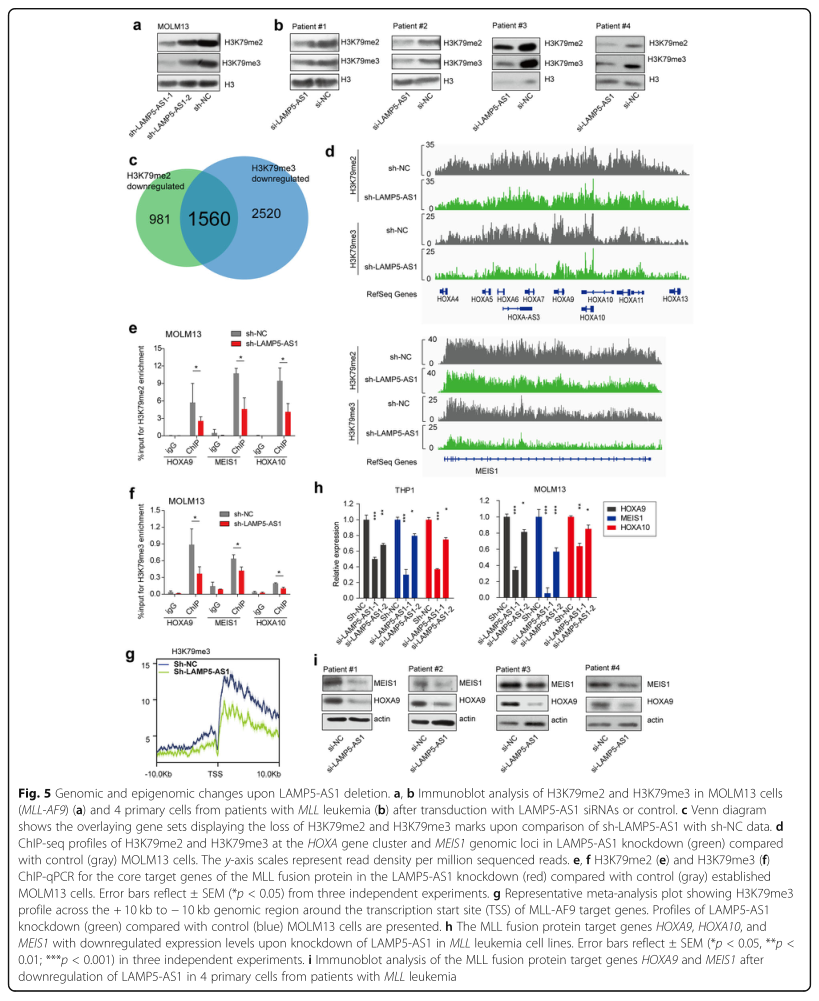
图5
6. LAMP5-AS1可作为MLL白血病不良预后的预测因子
最后,为评估LAMP5-AS1的临床相关性,研究者重新分析了419例患者样本,结果显示LAMP5-AS1在这些组之间存在差异表达,且在MLL白血病中的表达水平最高(图6A),进一步检测了7例配对MLL白血病患者,结果显示与MLL融合蛋白水平呈显著正相关的LAMP5-AS1在CR样本中的表达与初步诊断样本相比显著降低(图6B)。这些结果提示LAMP5-AS1的特异性上调可能是MLL白血病的一个有用的生物标志物。随后,ROC曲线分析和生存率分析也证明,LAMP5-AS1的高表达与MLL白血病患者的预后不良密切相关,表明该lncRNA可作为MLL白血病未来诊断和预后的生物标志物(图6C,D)。
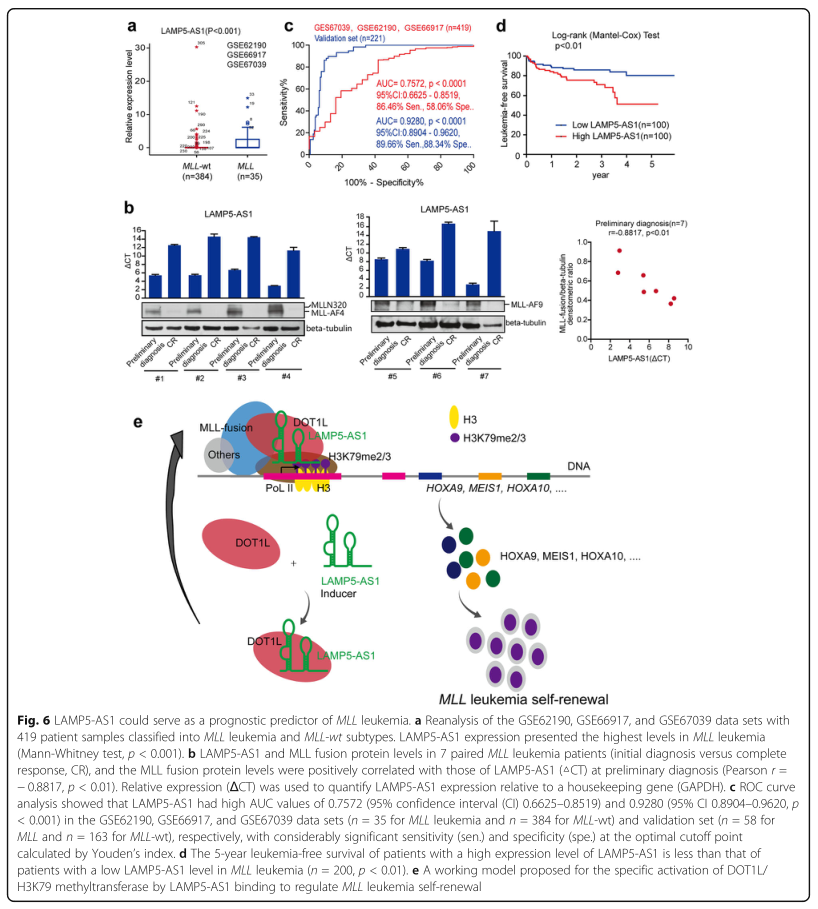
图6
结论:
研究结果表明,lncRNA LAMP5-AS1在MLL白血病细胞的自我更新过程和分化阻滞中起着重要的作用。LAMP5-AS1对维持DOT1L在MLL白血病中的高酶活性具有重要意义,可能成为治疗MLL白血病的一个有价值的靶点。









 实验热线:4006991663
实验热线:4006991663










