中文标题:NCoR/SMRT共抑制子与c-MYC合作为体细胞重编程创造表观遗传屏障
发表期刊:Nature Cell Biology
中科院分区:1区
影响因子:28.213
发表时间:2018年4月
合作单位:中国科学院再生生物学重点实验室
运用技术:LC-MS/MS蛋白质谱鉴定(由辉骏生物提供技术支持,点击查看服务详情)
● 研究背景
强制性表达已定义的外源因子(最初是OCT4,SOX2,KLF4和c-MYC(OSKM)可将体细胞重编程为诱导多能干细胞(IPSC)。在重编程开始时,外源OSKM与整个基因组的DNA结合,并诱导连续几轮染色质重组,从而激活整个多能性基因网络。然而,OSKM不是孤立运作的,需要共同的调节者来改变局部的表观遗传环境。尽管有关重编程中的转录和表观遗传反应的研究越来越多,但有关OSKM和不同的转录共调节因子(共激活因子和共抑制因子)如何相互作用或拮抗以诱导多能状态目前仍知之甚少。
● 研究结果
1. NCoR/SMRT共抑制子为OSKM重新编程设置了障碍
首先,研究者检测了NCOR1(编码NCoR)和Ncor2(编码SMRT)在小鼠胚胎成纤维细胞(MEF)、胚胎干细胞(ESC)和OSKM重编程细胞中的表达。结果显示,这两种共抑制因子在三种细胞类型中都有表达。接下来,研究者敲除了用OSKM逆转录病毒转导的OG2 MEF中的NCOR1/2,结果显示敲除任何一个共抑制子都能显著增加Oct4绿色荧光蛋白阳性(Oct4-GFP+)集落的数量(图1A,B),而且集落出现得更快(图1C)。抑制NCOR1/2增强了使用不同介质(包括高效率介质)的OSKM的重新编程,而与转导方法、报告系统或MEF的类型无关。为了解NCoR和SMRT是如何阻止重编程的,研究者在OSKM重编程的第5天和第9天对血清+VC中的NCOR1/2耗尽细胞进行了RNA-seq(图1E),两种基因敲除中差异表达的基因相似(图1E),但Ncor2基因敲除的整体效应更强(图1E)。NCOR1/2敲除后,许多富含MEF的体细胞基因在第5天被上调,在第9天变得不明显(图1F),而与间充质向上皮转化相关的基因在这两个时间点都没有受到影响。在第9天时,还出现了多能相关基因的上调。这些结果表明,在OSKM重编程中敲除NCOR1/2首先导致体细胞基因抑制的暂时性缺陷,然后加速和更有效地激活多能性基因。
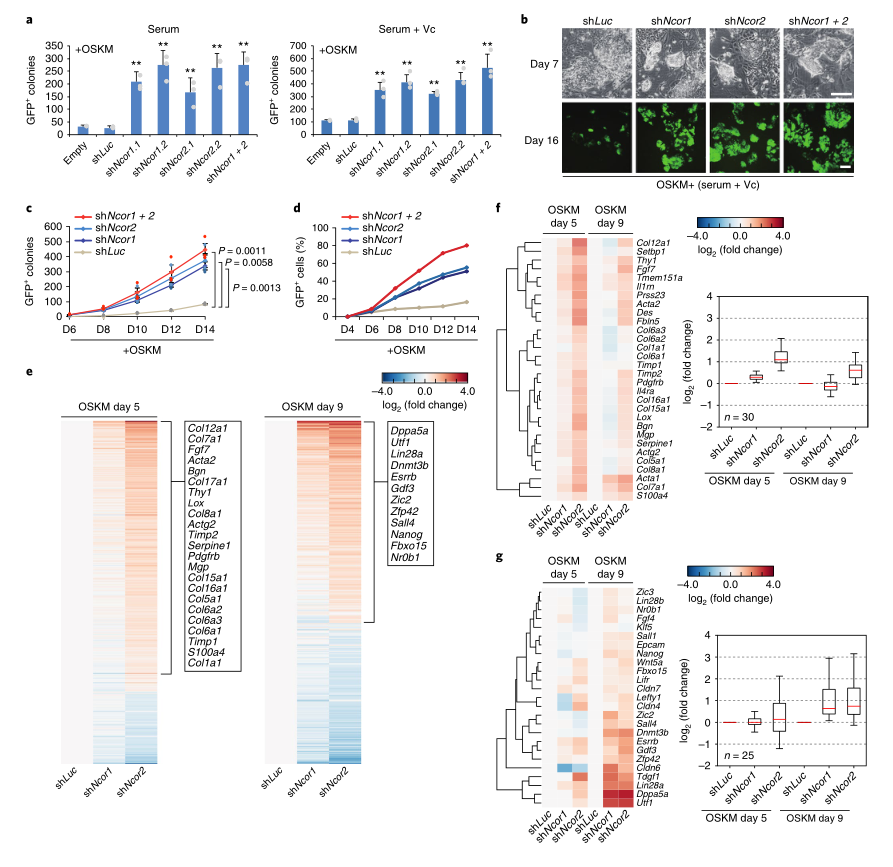
图1
2. NCoR/SMRT共抑制器需要HDAC3来破坏重新编程
NCoR和SMRT作为连接转录因子和表观遗传修饰因子的对接平台来调节染色质,包括不同的组蛋白脱乙酰酶(HDAC)家族成员。HDAC是调节NCoR/SMRT对OSKM重编程的有害影响的良好候选者,因为泛HDAC抑制剂如丙戊酸(VPA)或曲古菌素(TSA)可促进重编程。研究者观察了HDAC1到HDAC11在MEF、ESC和OSKM介导的重编程过程中的表达。HDAC8、9、10和11在这三种细胞类型中都不表达,而HDAC7只在MEF和重编程期间表达,在ESC中表达下调,HDAC1到HDAC6在三种细胞类型中都有表达(图2A)。接下来,研究者敲除了OSKM重编程中HDAC的表达(图2B),HDAC3敲除显著增加了重新编程,而在其他HDAC中,只有HDAC2敲除可以增强重新编程(图2B)。相反,HDAC4、5和7被敲除会损害重编程(图2B),另外两个针对HDAC3的ShRNA也提高了重编程效率(图2C)。此外,VPA没有与HDAC3敲除协同促进重编程(图2C),这表明PAN-HDAC抑制剂通过抑制HDAC3促进OSKM重编程。
研究者使用一个脱乙酰酶零突变体HDAC3(HDAC3-YF)和一个双突变体HDAC3 (HDAC3-YF-Ka)(图2D)进行了过表达实验,选取HDAC1(HDAC1-YF)和HDAC2(HDAC2-YF)对照。过表达HDAC1-YF和HDAC2-YF适度促进了OSKM重编程(图2E),而HDAC3-YF有效地增强了OSKM重编程(图2F),重要的是,HDAC3-YF-KA突变体中HDAC3-YF对重编程的促进作用在HDAC3-YF-KA突变体中消失,表明HDAC3-YF需要与NCoR/SMRT相互作用,才能作为HDAC3的显性负值(图2D,E)。这些结果表明,HDAC3介导NCoR/SMRT对OSKM重编程的负效应,这一功能需要脱乙酰酶活性,但抑制NCoR/SMRT和HDAC3对体细胞基因的影响并不相同。后者或许可以用以下事实来解释:目标位点的NCoR/SMRT耗尽会抑制其他酶活性,也可能招募共同激活者。
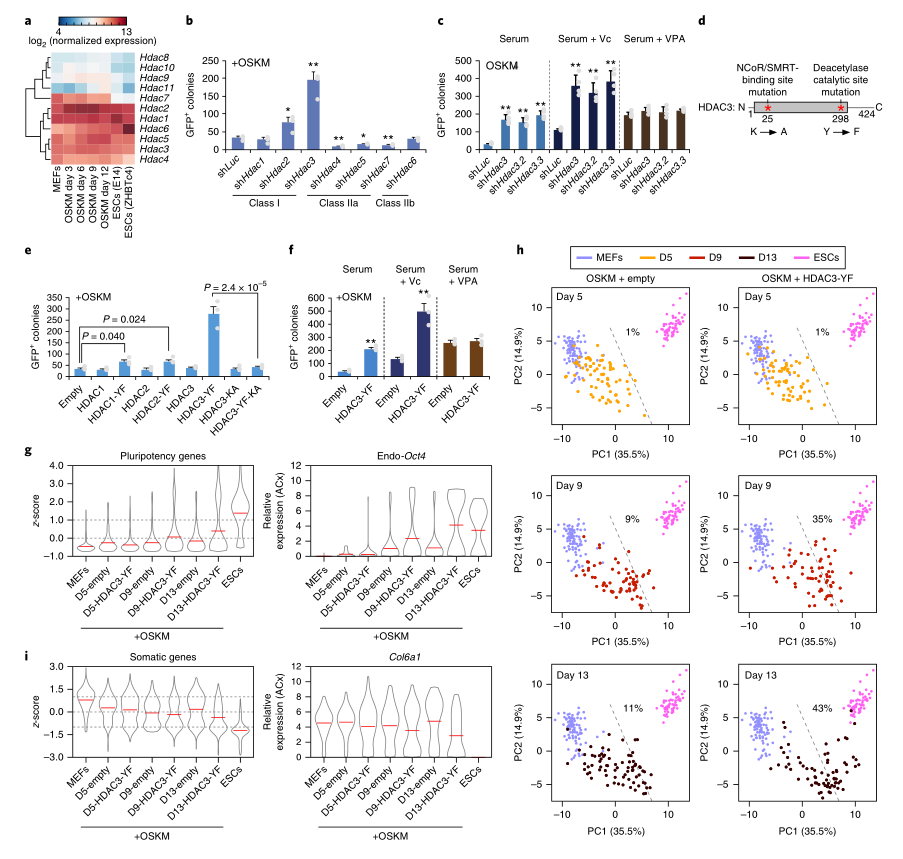
图2
3. 在重编程过程中,HDAC3诱导组蛋白在限制性基因组位点去乙酰化
为了了解HDAC3是如何损害OSKM重编程的,研究者通过免疫印迹分析了MEF、ESC和OSKM重编程中间产物中组蛋白H3乙酰化(AcH3)和组蛋白H4乙酰化(AcH4)的总水平。结果显示,胚胎干细胞的AcH3和AcH4水平均高于MEF(图3A),且在VPA或TSA增强的OSKM重新编程中,AcH3和AcH4的水平均有增加(图3A,B)。然而NCoR/SMRT的缺失或HDAC3-YF的过表达并没有进一步增加AcH3或AcH4的水平,且受NCoR/SMRT-HDAC3调控的两个具有代表性的乙酰化组蛋白标记H3K27ac和H4K12ac也出现了同样的情况(图3C,D)。CHIP-Seq实验表明,NCoR/SMRT-HDAC3复合体在特定的细胞环境中以总基因组的一小部分为靶标。接下来,研究者测量了所有转录起始位点(TSS)的H3K27ac水平,结果表明HDAC3-YF过表达对OSKM重编程中H3K27ac水平的影响是直接的。这些结果表明,HDAC3可能作为NCoR/SMRT复合体的一部分,通过在包括多能位点在内的限制性位点诱导组蛋白去乙酰化来损害OSKM重编程。

图3
4. NCoR/SMRT在重编程中对多能性位点的上下文特定招募
研究者对第9天OSKM重编程进行了CHIP-Seq,以研究NCoR/SMRT是否被招募到多能位点,通过HDAC3诱导组蛋白去乙酰化。结果显示,很大一部分NCoR/SMRT结合峰在重新编程(76%)和ESC(56%)中共享(图4A,B)。GO分析表明,在第5组和第15组,尤其是第5组,NCoR/SMRT结合位点在干细胞相关术语中得到丰富,而在第7组中,NCoR/SMRT结合位点在分化相关术语中得到丰富(图4C)。NCoR/SMRT仅在重编程期间才被招募到多能性基因座Sox2和Prdm4 ,这些基因座在重编程中显示出比ESC中更低的H3K27ac水平(图4D)。ChIP-qPCR证实了NCoR/SMRT在重编程时与Nanog和Utf1启动子结合,在ESC中的结合程度较小(图4E),而在MEF中几乎没有NCoR/SMRT结合。这些结果表明,NCoR/SMRT招募到多能位点会使重编程脱轨,而在ESC中,这些共抑制因子具有不同的功能,可能与发育过程中的组织规格有关。
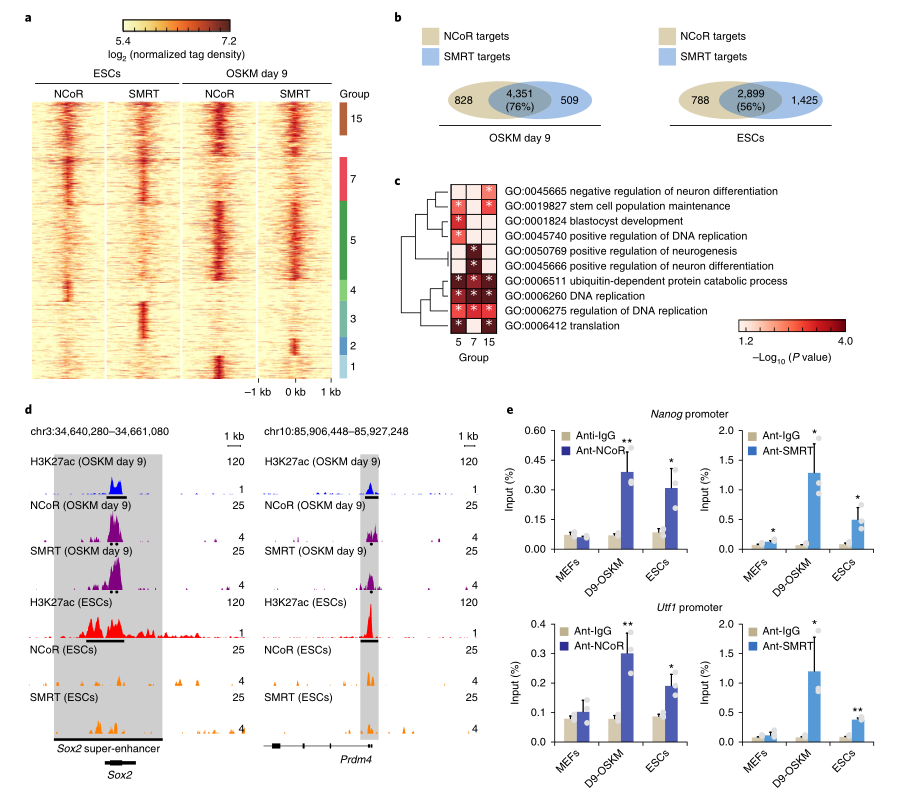
图4
研究者为模拟多能性状态,探究HDAC3-YF过表达是否有助于增加NCoR/SMRT靶基因位点的H3K27ac水平,在重新编程的第5、9和13天测量了所有NCoR/SMRT结合位点的H3K27ac水平,并在重新编程的第9天测量了所有NCoR/SMRT结合位点的ESC水平。结果显示,对于所有被NCoR/SMRT结合的位点,早期重新编程时间点的H3K27ac水平较低,尤其是在HDAC3-YF和ESCS中,在第13天升高(在第9天则降低)(图5A)。在对NCoR / SMRT结合组5和15(图5B,C)进行重编程时测量H3K27ac水平以及在重编程中被NCoR / SMRT结合的“第二波”基因中检测到了相似的结果(图5D)。此外,为了研究HDAC3-YF对NCoR/SMRT结合位点H3K27ac水平的增强作用是否与基因表达增加有关,我们对NCoR/SMRT结合的一组多能性相关基因(包括许多“第二波”基因)在TSS的2kb范围内进行了RT-qPCR。结果显示NCoR/SMRT结合、重编程第13天H3K27ac水平升高(第9天较低)与HDAC3-YF过表达时基因表达增加之间有很好的相关性(图5E),在NCOR1/2基因敲除时也得到了类似的结果。相比之下,在重新编程的第9天,一组在ESC中的表达高于MEF的第二波基因,在TSS的20kb范围内没有NCoR/SMRT结合,在HDAC3-YF的第9天或第13天,H3K27ac水平几乎或没有增加。然而,ESC中这些位点的H3K27ac水平明显低于第5组和第15组(图5B,C)。胚胎干细胞在某些发育基因上显示出适度的H3K27ac水平,这使得它们能够在分化过程中迅速激活。这些结果证实了NCoR/SMRT通过HDAC3介导组蛋白去乙酰化来抑制多能性基因的重新激活。
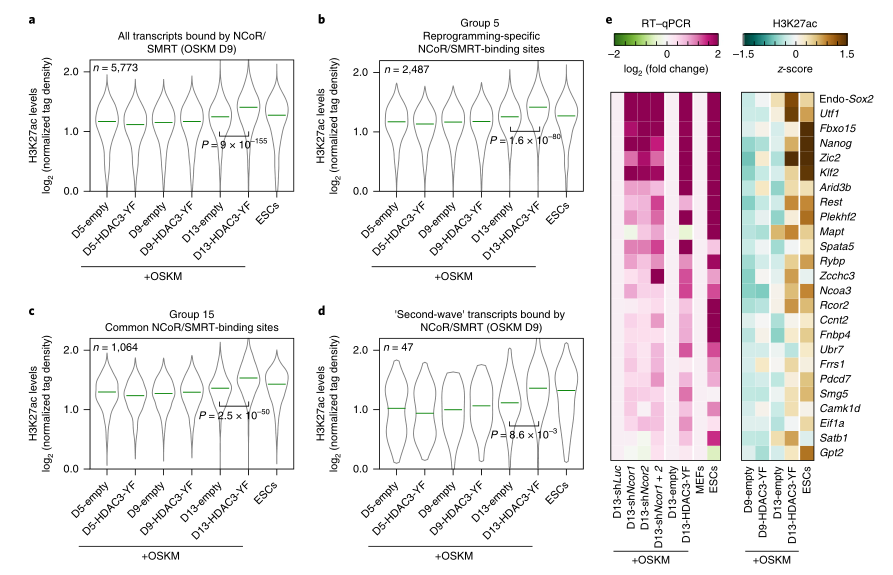
图5
5. c-MYC在重新编程时招募了NCoR / SMRT–HDAC3复合体
外源OSKM因子是将NCoR/SMRT-HDAC3募集到DNA的有力候选者。HEK293T细胞中的免疫共沉淀证实了OSK与NCoR / SMRT的相互作用,但与c-MYC的结合更强(图6A)。值得注意的是,这种c-MYC-NCoR/SMRT间的相互作用需要NCoR和SMRT的氨基末端结构域(图6B,C),这是行使抑制功能所必需的。在OSKM重编程的第9天,研究者用外源性c-MYC和内源性HDAC3在血清+VC中免疫共沉淀NCoR和SMRT的N端(图6D),结果显示,外源性c-MYC可以共沉淀内源性HDAC3(图6E)。ChIP-seq分析发现,NCoR/SMRT中还存在着一个c-MYC结合基序(图6F)。此外,NCOR1/2基因敲除未能提高OSK(图6G)的重编程效率,HDAC3-YF的表达对OSK(图6H)的重编程也没有有利影响。
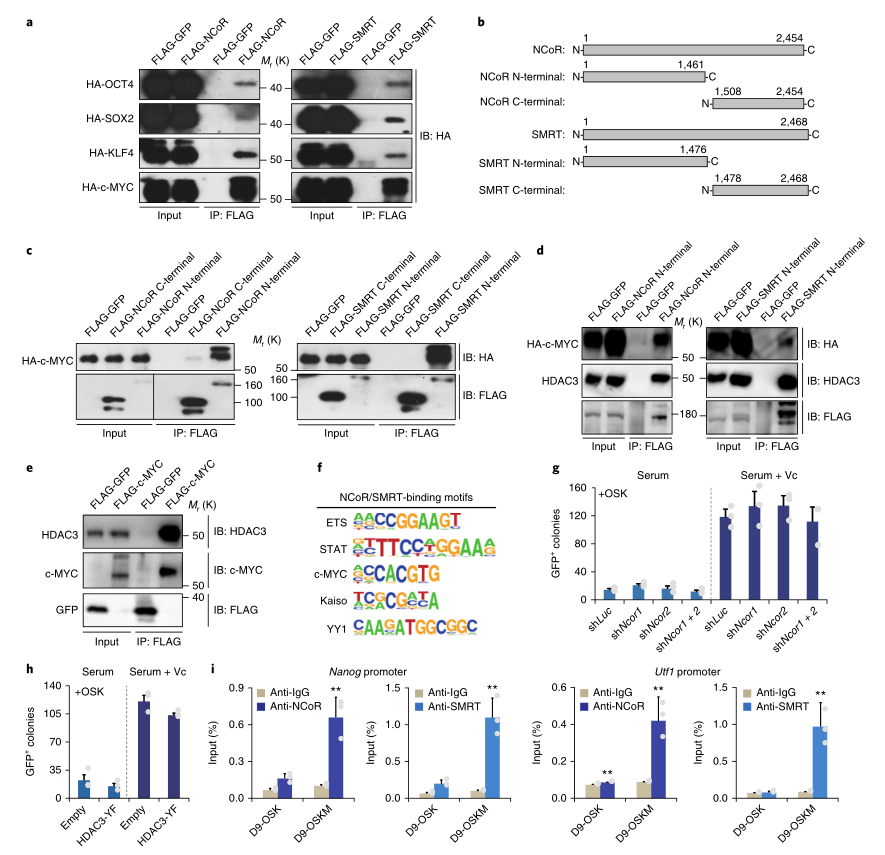
图6
为研究NCoR/SMRT和c-MYC结合位点之间的全基因组相关性,研究者比较了NCoR/SMRT的结合与OCT4、SOX2、KLF4和c-MYC的结合情况(图7A)。IPSC前体是稳定的克隆细胞系,在OSKM重编程中经常出现,它经历了重新编程的初始阶段,但是未能激活多能网络。在IPSC前体中,NCoR/SMRT与OSKM的重叠最强的是c-MYC,其次是KLF4和OCT4/SOX2(图7B,C)。IPSC前体的NCoR / SMRT和KLF4之间的大部分重叠位点都被c-MYC结合(图7D),但是这些位点中的很大一部分在这三个重编程因素之间共享(图7E-G)。因此,在四个山中因子中,c-MYC主要有助于将NCoR / SMRT募集到基因组位点(包括多能性位点),从而对重编程产生负面影响。
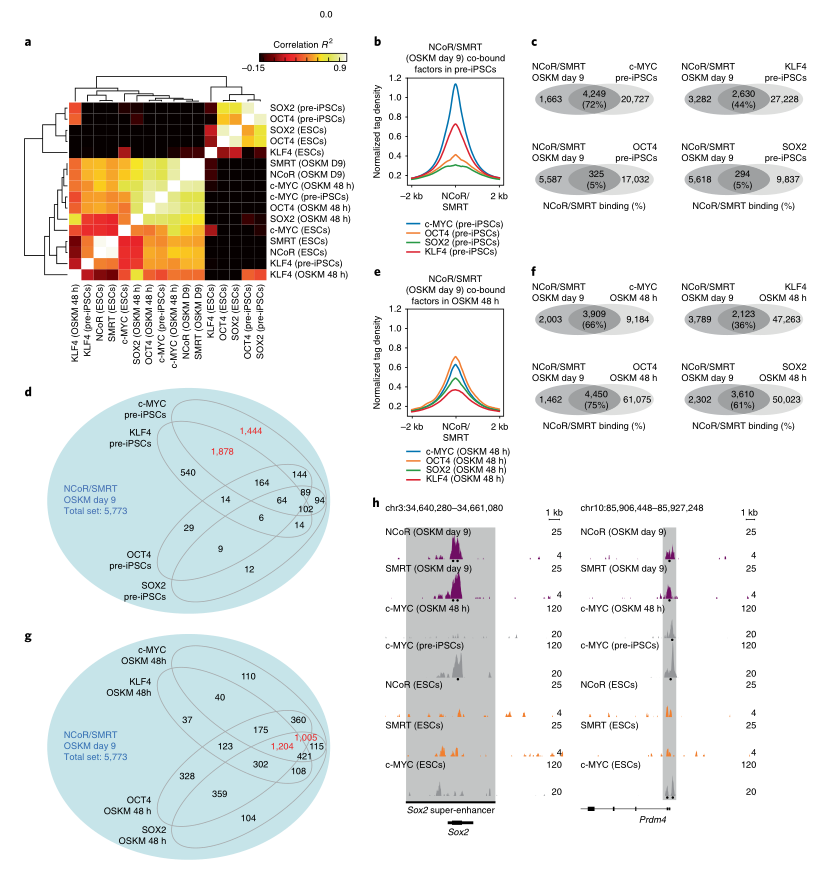
图7
6. 外源c-MYC在重编程中的双重作用
为了进一步评估c-MYC和NCoR/SMRT在重编程中抑制多潜能基因的关系,研究者构建了由Oct4末端增强子(Oct4-DE)驱动的DsRed慢病毒报告程序(图8A)。该报告整合到基因组中,可以通过多能转录因子的结合直接激活,而无需进行完全重编程。OCT4、SOX2或KLF4在MEF中的单独过表达略微激活了报告因子,但它们的组合具有协同作用(图8B,C)。相比之下,c-MYC单独没有激活作用,但与OSK结合使用会削弱报告基因活性的增加(图8B,C)。研究者进一步用OSK和多西环素诱导的c-MYC重新编程MEF(图8D)。从第3-9天开始诱导c-MYC导致干细胞标记碱性磷酸酶阳性的菌落数量达到峰值,这在重新编程中相对较早出现,而如果在整个实验过程中诱导了c-MYC,则这种增加不会进一步改变(图8E)。c-MYC诱导后第3天至第9天Oct4-GFP+集落数量也达到高峰,但随着诱导时间的延长,Oct4-GFP+集落数量明显减少(图8F)。这些结果都表明,VP16工程转录因子提高重编程效率的一个机制是通过抵消由OSKM,特别是c-MYC招募的NCoR/SMRT共抑制子对多能性位点的负面影响。

图8









 实验热线:4006991663
实验热线:4006991663












