中文标题:MEX3A/circMPP6复合体通过抑制自噬促进结直肠癌发展
发表期刊:Signal Transduction and Targeted Therapy
中科院分区:1区
影响因子:40.8
发表时间:2024.04
合作单位:中山大学附属肿瘤医院
运用技术:IP MS结合蛋白鉴定(由辉骏生物提供技术支持,点击查看服务详情)

背景:
P小体(PBs)是细胞质中的一种无膜细胞器,也被称为细胞质加工小体,通过液-液相分离(LLPS)形成,是由RNA和RBP组成的一个聚集体,其功能主要涉及mRNA的降解和翻译的抑制。
已知PBs稳态与缺氧、营养饥饿等多种应激密切相关,鉴于应激条件在肿瘤微环境中的重要作用,推测PBs形成的失调可能在肿瘤病理过程中发挥作用。mex3 RNA结合家族成员A (MEX3A)是一种RBP,与各种RNA代谢有关,包括mRNA稳定性、miRNA在细胞核和细胞质之间的转运。越来越多的证据表明,MEX3A参与了多种癌症的进展。circRNAs主要通过海绵作用microRNA或与RBP相互作用来发挥功能。此外,circRNAs可以作为蛋白质的诱饵、支架和招募者,影响蛋白质的相互作用或定位。
内容概述:
2024年4月,中山大学附属肿瘤医院的研究人员在国际期刊Signal Transduction and Targeted Therapy上发表新论文,描述了MEX3A在结直肠癌细胞恶性特性和自噬活性中的作用。研究结果表明,MEX3A经历LLPS并协调活细胞中PBs成分的募集。circMPP6作为关键支架,促进了MEX3A和PBs组分之间的相互作用,进而促进了CRC细胞中PBs的形成。MEX3A/circMPP6复合物可以影响PDE5A mRNA的降解,从而引发CRC细胞的侵袭性。临床上看,MEX3A表达高、PDE5A表达低的结直肠癌患者预后较差。总的来说,该论文揭示了RBP/circRNA复合物在调节PBs稳态中的重要作用,为结直肠癌患者的预后评估和治疗干预提供了乐观的前景。
研究路线:
1. 数据库分析和表达检测:MEX3A在CRC组织中显著上调;
2. RIP-seq和功能检测:MEX3A通过抑制自噬来促进CRC进展;
3. 结构分析和CoIP MS:MEX3A通过内在无序区(IRDs)经历LLPS,并与MOV10、PABP1和UPF1相互作用形成PBs;
4. RIP和RNA Pull-down:circMPP6分别与MEX3A和PBs组分MOV10相互作用来促进CRC;
5. CoIP和RIP:circMPP6通过影响MEX3A-PBs组分的协作来促进PBs的维持;
6. RNA-Seq和RNA Pull-down:MEX3A/circMPP6招募了UPF1来启动自噬关键蛋白PDE5A mRNA的降解,促进CRC发展。
研究结果:
1. MEX3A在CRCs中高表达,促进CRC细胞恶性并抑制自噬
Cbiopportal (http://www.cbioportal.org)分析发现癌症相关RBP“MEX3A”在人类CRC中显著高表达(图1a, b)。免疫组化(IHC)证实MEX3A在CRC组织中显著上调(图1c-e),且与CRC临床分期及T、N分期正相关,预示较差的患者总生存期(OS) (P < 0.05;图1 f)。敲低或过表达MEX3的细胞和动物模型实验发现,MEX3A加重了CRC进展。
为了寻找MEX3A的结合mRNA,作者在CRC细胞中进行RIP-seq。KEGG pathway表明结合RNA主要富集于FoxO自噬相关通路,提示MEX3A可能与CRC细胞自噬有关。进一步的实验证明,在血清饥饿时,敲低MEX3A促进了自噬(自噬活性标志物LC3-II增加、自噬底物p62降解增加);自噬溶酶体抑制剂氯喹(CQ)的处理阻断了饥饿诱导的p62水平降低(图1g)。mRFP-GFP-LC3自噬通量检测显示,敲低MEX3A导致CRC细胞中的自噬体和自溶体数量明显增加(图1i),过表达结果与之相反。这些数据表明,MEX3A抑制自噬,从而促进CRC进展。
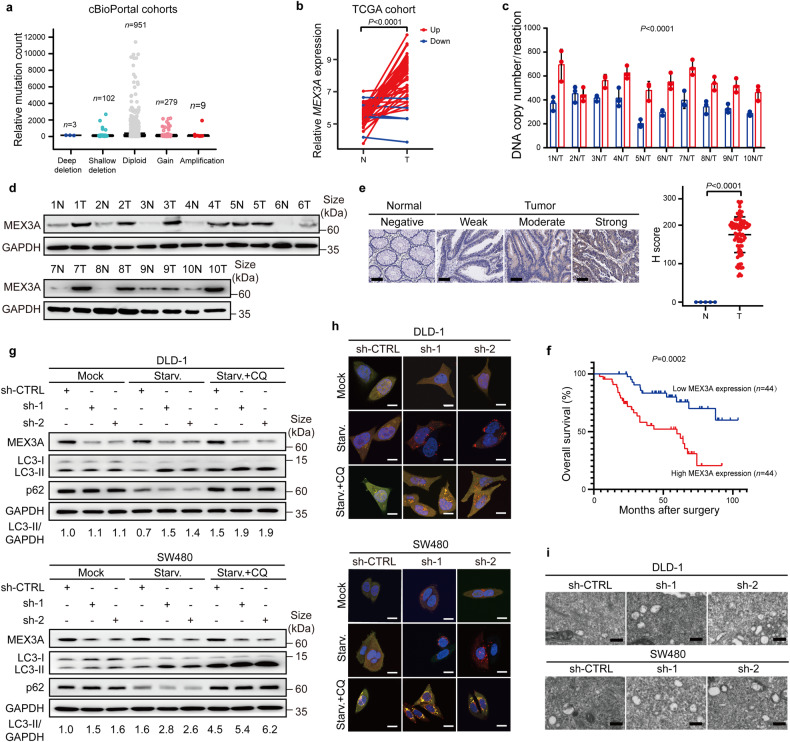
图1
2. MEX3A依赖内在无序区形成PBs,且与PBs组分蛋白相互作用
IUPred2A工具(http://iupred2a.elte.hu)预测到MEX3A蛋白有几个内在无序区(IRDs) (图2a),可能导致相分离液滴的形成,因此构建了MEX3A全长和两个截短突变质粒,分别在体外和体内条件下验证此推论(图2b)。体外条件下,全长MEX3A蛋白溶液在4°C时透明,随温度升高至37°C逐渐不透明(图2c)。溶液中MEX3A和NaCl浓度的升高会增加微米级液滴的大小和数量(图2d)。截短IDRs的液滴大小和数量显著增加,删除IDRs不能观察到液滴(图2c, d)。当EGFP-MEX3A及其突变体质粒转染CRC细胞后,EGFP-MEX3A在细胞质中呈离散点状分布,光漂白后荧光恢复(FRAP)实验观察到液滴都在光漂白后6 min内恢复了70%;EGFP-MEX3A-IDRs在细胞质中出现大量液滴状凝聚物,在光漂白后6 min内恢复了90%;EGFP-MEX3A-IDRs△组仅有少量液滴,且在光漂白后无法恢复 (图2e-f)。此外,IDRs缺失还减弱了因MEX3A过表达导致的皮下肿瘤生长。这些结果表明,MEX3A的IDRs是其LLPS和促进CRC肿瘤发生所必需的。
293T细胞的免疫共沉淀(Co-IP)和质谱(LC-MS/MS)筛选了MEX3A的相互作用蛋白,发现了MOV10、UPF1、DDX6和PABP1等几个PBs相关RBP (图2g)。coip和免疫荧光(IF)实验验证了MEX3A与MOV10、PABP1和UPF1之间的结合(图2h-i),表明MEX3A蛋白是PBs的一个组成部分。
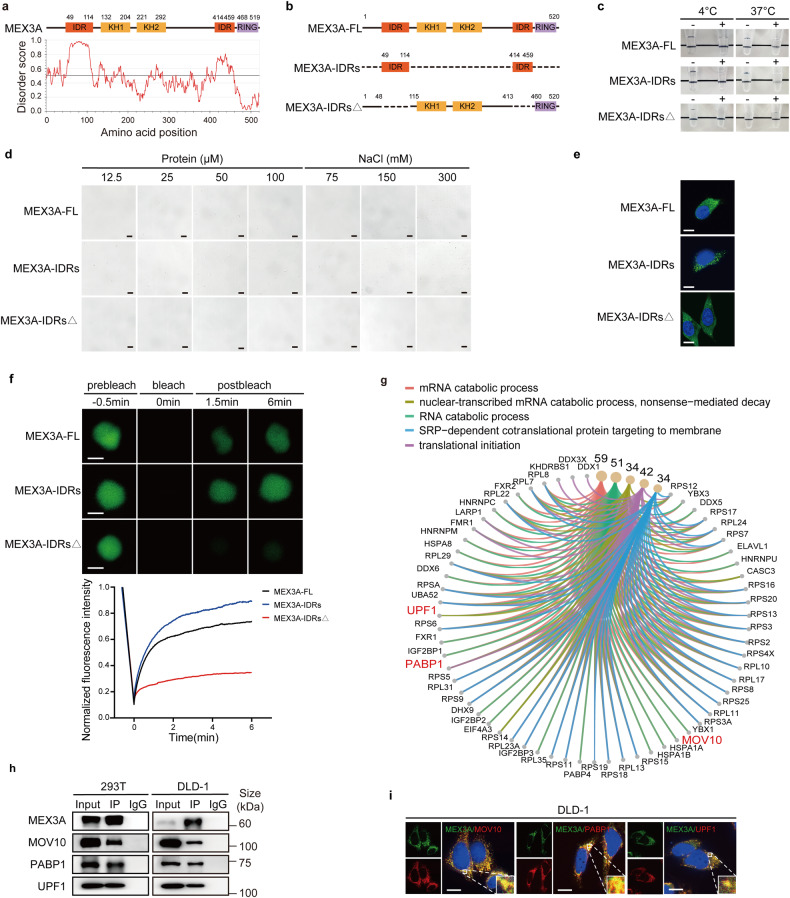
图2
3. PBs中的MEX3A与circMPP6结合
鉴于PBs是由关键蛋白和RNA的局部高浓度引起的,作者进行了MEX3A蛋白的RIP实验和小RNA测序来筛选PBs稳态相关的circRNA。结合CircInteractome工具(https://CircInteractome.nia.nih.gov/)对MEX3A和MOV10蛋白的结合circRNA的预测,选定circ_0001686(也叫circMPP6)做进一步研究(图3a)。Sanger测序验证了其反向剪接连接位点(图3b),FISH表明circMPP6在细胞质呈点状分布(图3c)。RIP和RNA Pull-down发现circMPP6与MEX3A和PBs核心成分MOV10相互作用(图3d)。MEX3A、MOV10和circMPP6在胞质共定位,并且嘌呤霉素(一种刺激PBs形成的药物)的处理加速了circMPP6和MEX3A在细胞质的富集(图3f)。此外,过表达circMPP6大大增加了CRC细胞的增殖和迁移能力,其功能与MEX3A相似。这些结果表明circMPP6是MEX3A发挥作用的中间因子,MEX3A/circMPP6复合物的形成与CRC细胞中PBs的形成密切相关。
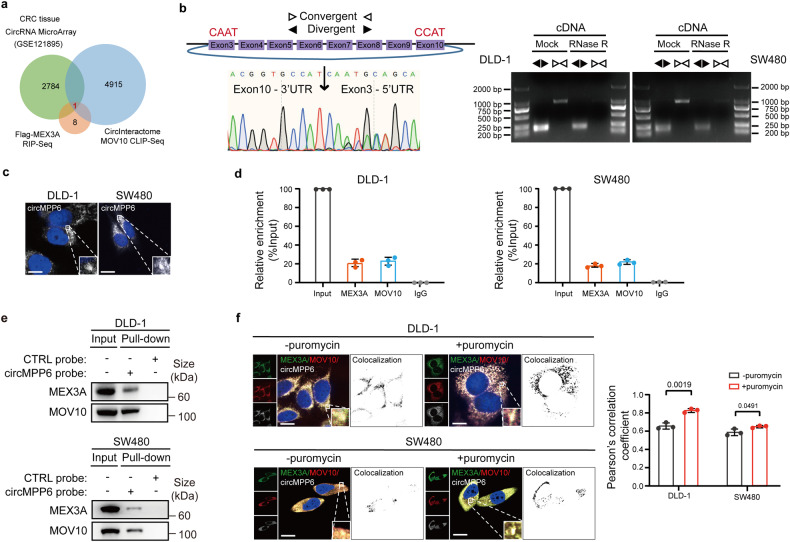
图3
4. circMPP6通过加强MEX3A-PBs组分的相互作用促进PBs聚集
circMPP6如何调节MEX3A的功能呢?已知MEX3A参与泛素化,circRNAs也可以调节蛋白降解,但敲低circMPP6不影响MEX3A及PBs组分的蛋白水平。当嘌呤霉素处理后,缺乏MEX3A/circMPP6可导致PBs解离,而细胞质中存在MEX3A和circMPP6融合体(图4a),推测MEX3A/circMPP6复合物可能调节PBs的组装。在sh-circMPP6-CRC细胞中进行等量MEX3A蛋白的IP实验,MOV10、PABP1和UPF1的丰度都减少了。蔗糖梯度沉降实验发现:MOV10、PABP1和UPF1蛋白的分布相似(图4b),MEX3A的积累与受circMPP6调控的PBs蛋白组分有关。
为了鉴定MEX3A与circMPP6结合的结构域,构架了MEX3A突变体进行RIP实验, 发现MEX3A的KH1和KH2结构域都与MEX3A/circMPP6复合物的形成有关(图4c),IP实验证实MEX3A还通过KH2结构域与3个PBs组分蛋白结合(图4d)。作者进行了挽救实验,敲低MEX3A引起的自噬促进、转移和增殖抑制可以被过表达野生型MEX3A(WT)所逆转(图4e-g),但不能被过表达KH2缺失型MEX3A所逆转,表明KH2结构域在MEX3A介导的结直肠癌侵袭性中起关键作用。RIP-Seq数据分析发现,CACU RNA序列是MEX3A的结合基序,而circMPP6的接口序列中存在CACU基序。RNA Pull-down和RNA-EMSA实验都证明了circMPP6通过CACU基序与MEX3A结合。
这些结果都提示circMPP6通过影响MEX3A-PBs组分的协作来促进PBs的维持。
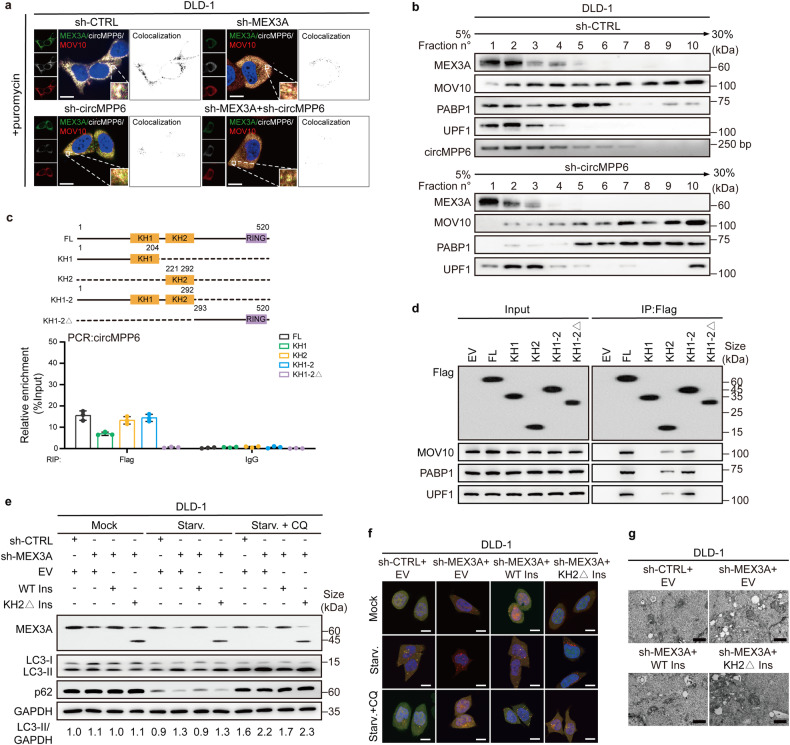
图4
5. MEX3A/circMPP6复合物促进PDE5A mRNA降解,调控CRC自噬
为了确定MEX3A的下游靶点,作者在对照和敲除MEX3A的CRC细胞中进行RNA-Seq,并结合MEX3A的RIP-Seq数据,找到了29个共有差异mRNA (图5a);再参考TCGA患者和CRC细胞的失调基因,最终得到10个候选基因。qRT-PCR和Flag-MEX3A-RIP确定了PDE5A、SENP7和TTLL7 mRNA受到MEX3A的调控和结合(图5b, c)。RNA Pull-down实验也显示circMPP6与这三种mRNA相互作用(图5d)。RIP-qPCR表明PBs组分MOV10和UPF1可以PDE5A mRNA结合 (图5e)。此外,在敲低MEX3A/circMPP6后,CRC细胞中PDE5A、SENP7和TTLL7 mRNA的稳定性显著增强(图5f),表明MEX3A/circMPP6复合物介导的PBs聚集影响mRNA的降解。由于MEX3A抑制自噬进程,因此PDE5A被确定为MEX3A的潜在靶点。
已知UPF1触发PBs的mRNA降解,作者推测MEX3A/circMPP6复合体可能招募UPF1启动PDE5A mRNA降解。通过RIP-qPCR和IF-RNA FISH实验证实了MEX3A/circMPP6的敲低显著降低了UPF1与PDE5A mRNA的结合,并且PDE5A mRNA的荧光强度增加(图5g-h),表明UPF1结合PDE5A mRNA并导致其降解的机制依赖于MEX3A/circMPP6复合体。
在敲低MEX3A的CRC细胞中再转染PDE5A-shRNA时,明显抑制了CRC的自噬(图5i-k),且促进了增殖和转移。异种移植模型也发现PDE5A的下调逆转了敲低MEX3A产生的肿瘤抑制作用(图5I),表明MEX3A在结直肠癌中的致癌作用依赖于PDE5A通路。
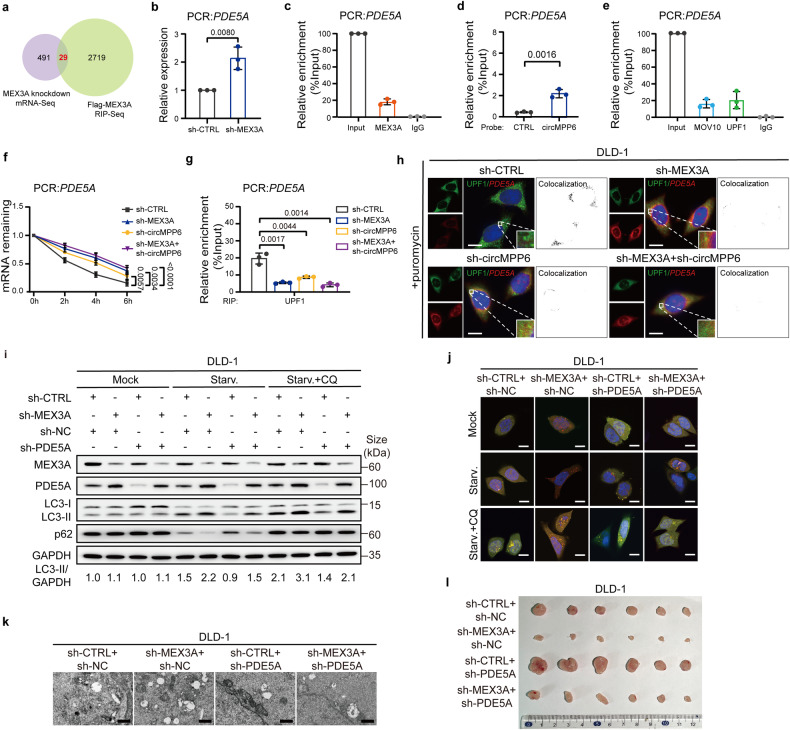
图5
6. MEX3A/circMPP6-PDE5A信号通路调控CRC发展
接下来,作者评估了MEX3A调控通路在结直肠癌患者中的临床意义,在TCGA和SYSUCC数据集、以及8个匹配的CRC和邻近非癌组织中,PDE5A的表达与MEX3A/circMPP6的水平呈负相关(图6a-c),并且高MEX3A和低PDE5A的CRC患者的OS最差(图6d)。这些结果证实MEX3A上调可显著减弱PDE5A的表达,从而在结直肠癌侵袭性和患者预后中发挥关键作用。
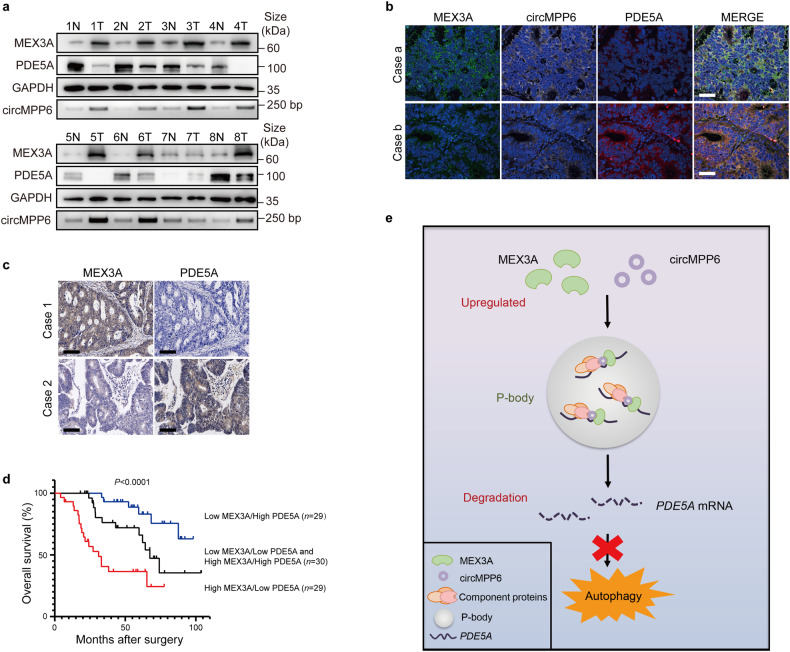
图6
结论:
该论文揭示了RBP/circRNA复合物在调节PBs稳态中的重要作用:circMPP6作为一个支架,介导了MEX3A与三种PBs相关蛋白(MOV10、PABP1和UPF1)的相互作用,促进了CRC细胞中PBs的形成。MEX3A/circMPP6复合物可以影响PDE5A mRNA的降解,从而引发了CRC细胞的侵袭性。










 实验热线:4006991663
实验热线:4006991663












