
背景:肝细胞癌(HCC)是全球第五大最流行的恶性肿瘤和第二大与癌症相关的死亡原因。它的发生归因于代谢物相关基因调控改变引起的细胞代谢重编程。有证据表明,糖代谢异常是癌症的突出特征,然而有关糖原调节的异常很少被研究。因此,明确这种异常代谢的机制或许可以为肝细胞癌的治疗提供新的靶点。
内容概述:
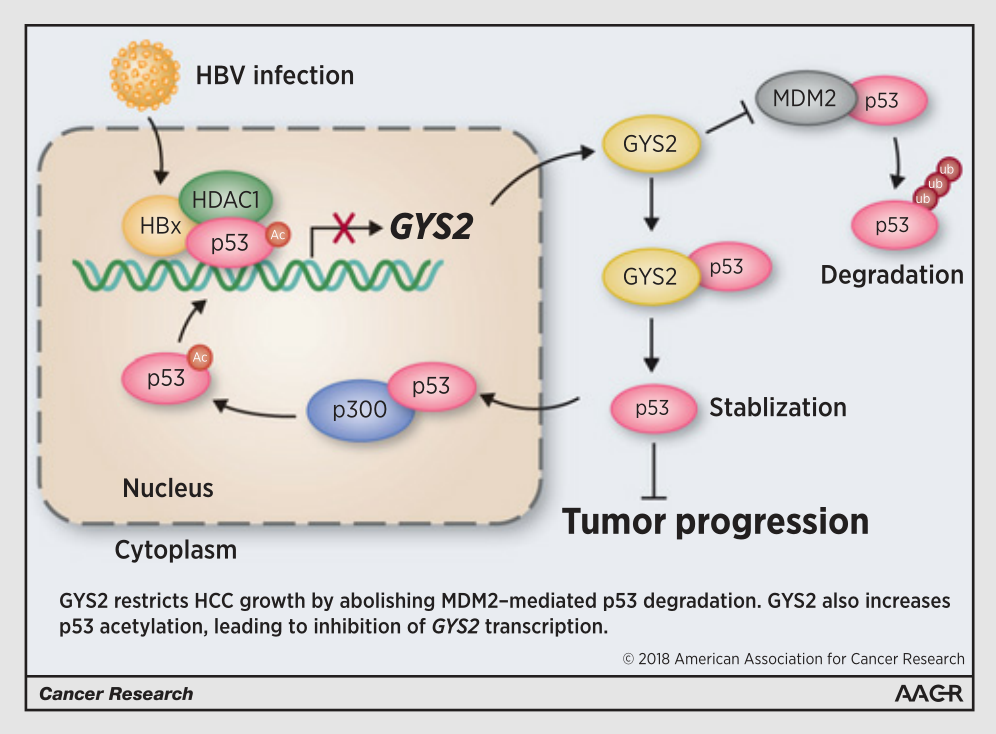
2019年2月,辉骏生物合作伙伴,中山大学肿瘤中心华南肿瘤学国家重点实验室在期刊Cancer Research(IF2019=9.727)上发表题为“A GYS2/p53 Negative Feedback Loop Restricts Tumor Growth in HBV-Related Hepatocellular Carcinoma”的最新论文,证明了糖原合成酶2(GYS2)通过p53的负反馈调节环来限制乙肝病毒相关性肝癌的生长。GYS2在HCC中的表达明显下调,并与糖原含量降低和不良患者预后相关。GYS2的低表达可通过调控p53来促进细胞体外增殖和体内肿瘤生长。GYS2与MDM2竞争性结合,阻止MDM2介导的p53泛素化和降解;GYS2还增强了p300诱导的p53蛋白K373/382位点的乙酰化,进而负反馈抑制了HBx/HDAC1复合物支持下的GYS2转录。研究结果提示:GYS2在HCC中作为一个预后因子和肿瘤抑制因子发挥作用,本研究中发现的HBx/GYS2/P53信号通路能够调节糖原代谢,为肝癌的临床治疗提供了一个有前途的治疗靶点。
主要技术:
Co-IP、RNA seq、ChIP、GST pull-down、双荧光素酶分析等;
辉骏生物为本研究提供了GST pull down技术服务。
研究路线:

研究结果:
1. 肝细胞癌中糖原含量降低
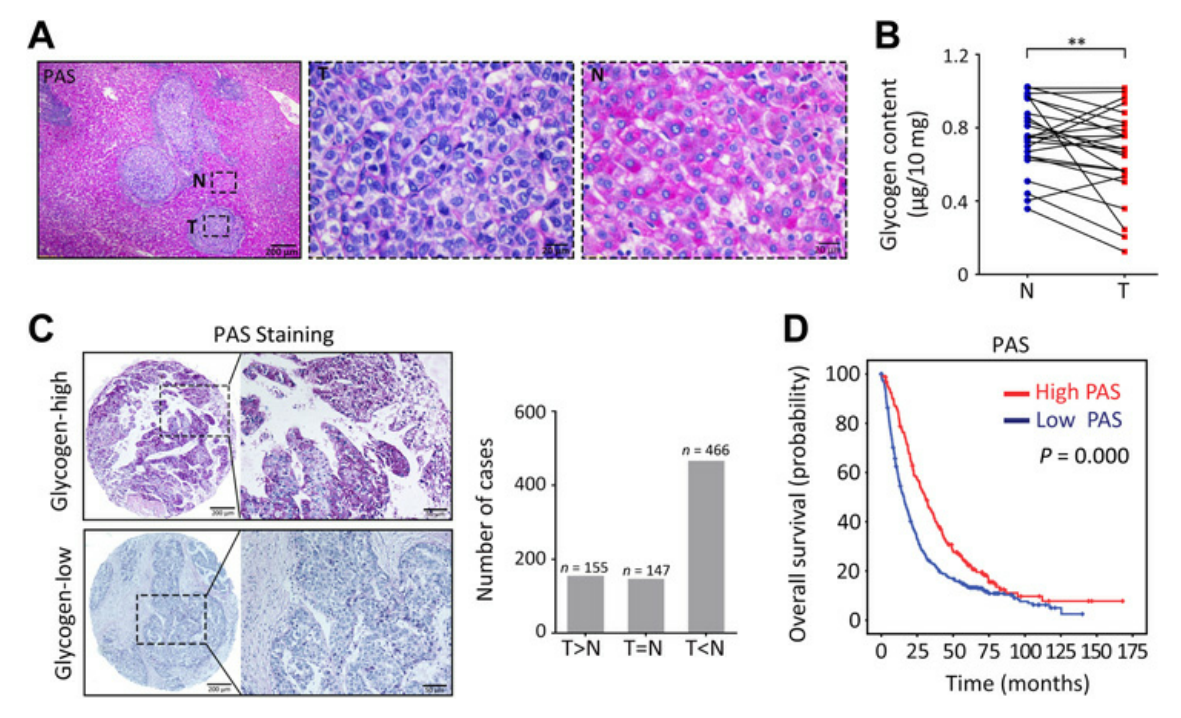
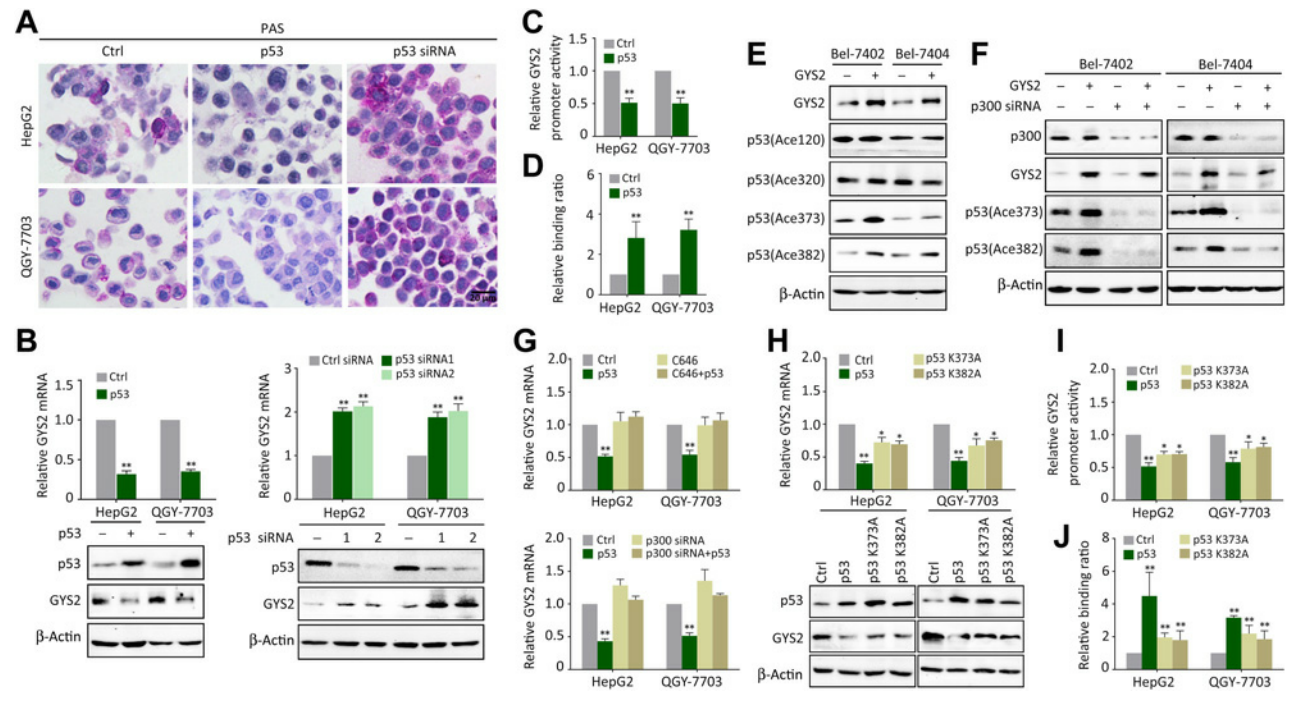
研究者通过PAS染色分析发现肝癌组织中的糖原与非肿瘤组织相比明显减少(图1A)。对768例HCC患者组成的样本进行PAS染色,根据阳性染色比例将患者分为高PAS组和低PAS组,Kaplan-Meier分析显示低PAS染色与总体生存情况不良相关(图1D),多变量Cox回归模型进一步显示糖原含量是HCC总生存率的独立预后因素。这些数据表明,肝细胞癌中糖原合成受到抑制。
2. GYS2在肝细胞癌中下调,并与不良患者预后相关
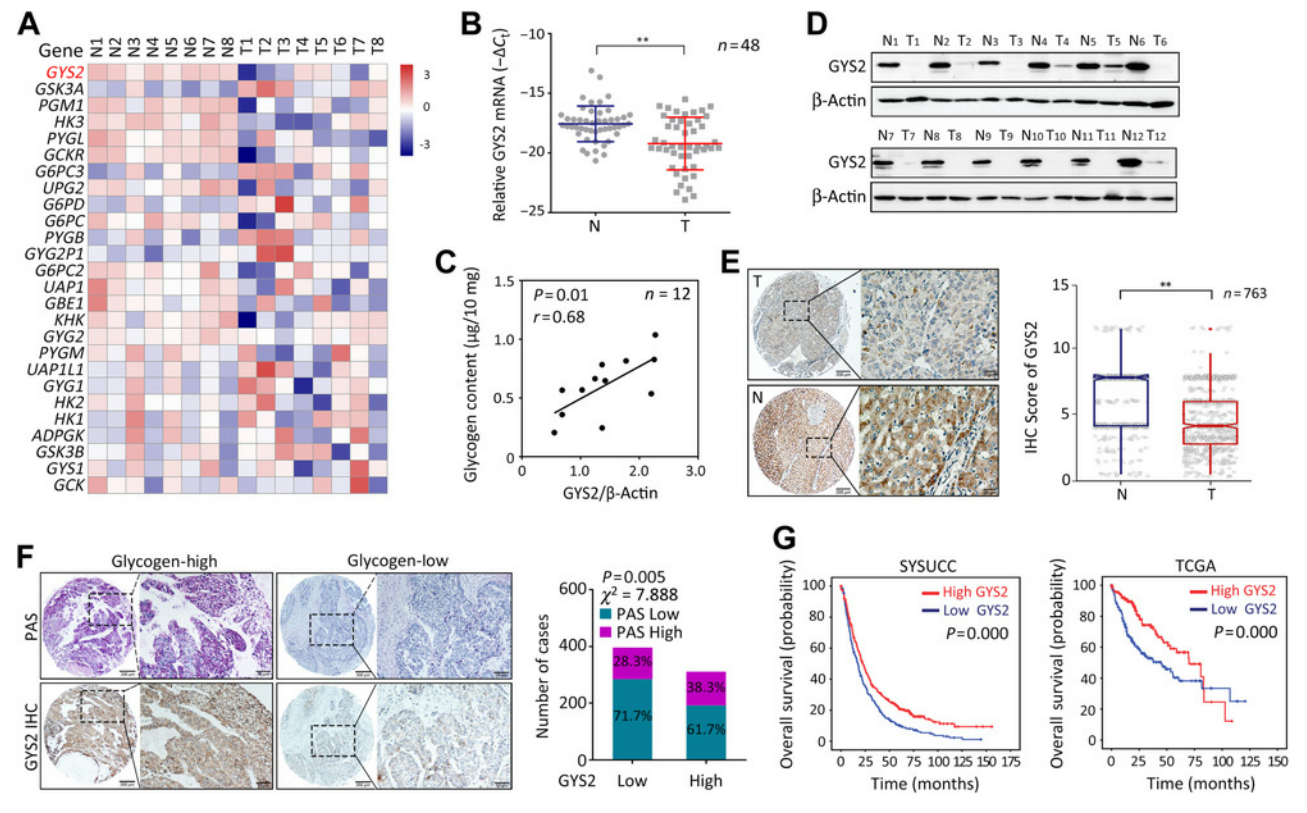
8对肝癌组织的RNA-seq转录谱显示:涉及糖原合成和代谢很多基因下调,其中GYS2显著下调(图2A)。之后分别对HCC细胞系、HCC新鲜肿瘤组织的mRNA和蛋白进行了检测,qPCR、Western Blot、免疫组化实验均证实GYS2在HCC样本中表达下调(图2B-F), PAS染色结果显示GYS2表达与糖原含量呈正相关 (图2F)。Kaplan-Meier分析显示,GYS2缺乏的患者在SYSUCC和癌症基因组图谱中的总体存活率都不佳(图2G)。多变量Cox回归模型和分层生存分析进一步表明GYS2是影响HCC总生存率的独立预后因素。
3. GYS2缺失促进肝癌体内外增殖
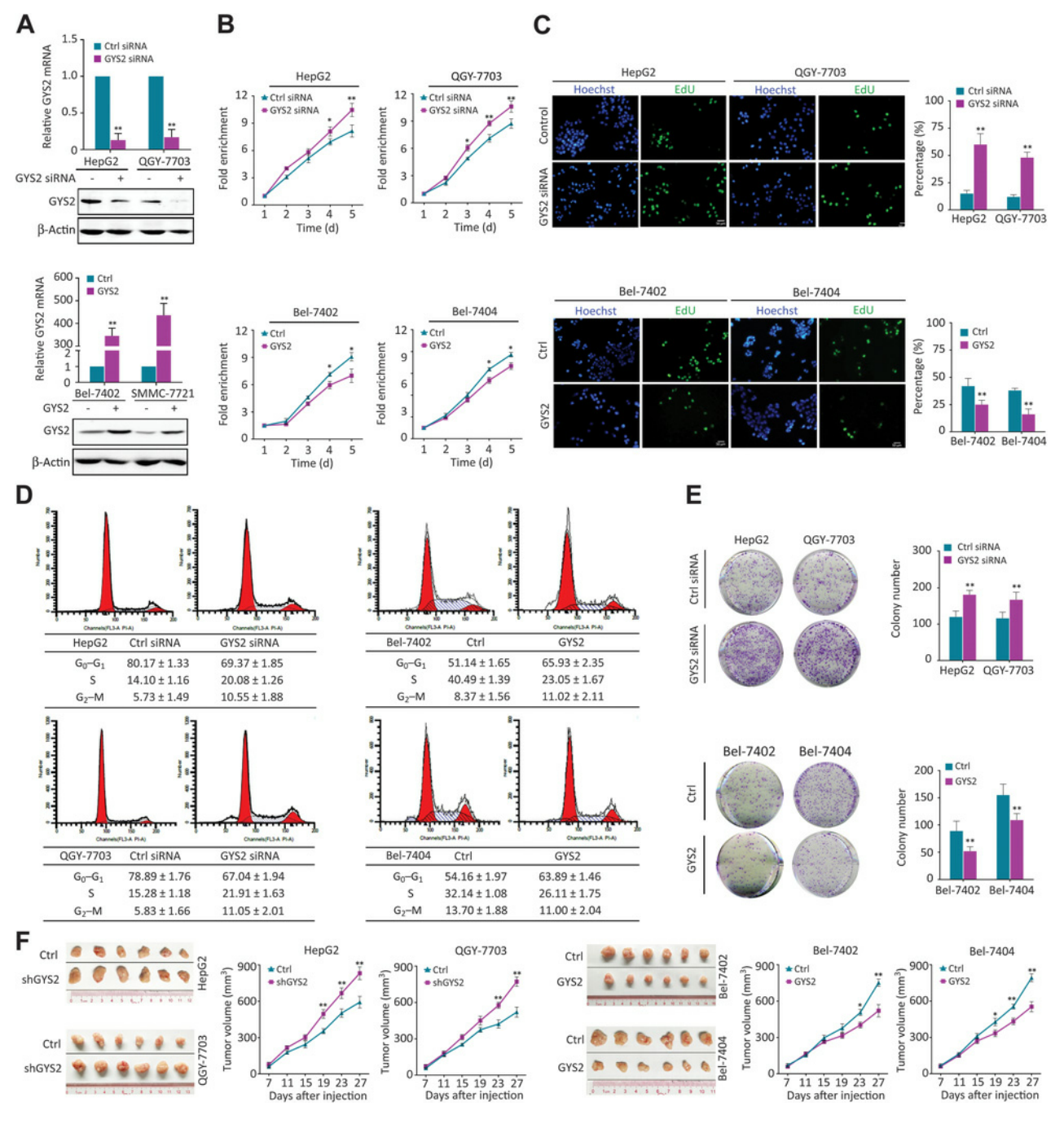
为了探讨GYS2在HCC中的生物学功能,研究者在HepG2和QGY-7703细胞中敲除GYS2,在Bel-7402和Bel-7404细胞中过表达GYS2(图3A),并进行了一系列细胞功能实验。MTT结果显示GYS2沉默导致细胞增殖能力显着增加,而过表达导致细胞增殖能力下降(图3B)。EdU实验表明GYS2基因敲除可显著诱导EDU阳性细胞,过表达使EDU阳性细胞减少(图3C)。流式细胞周期检测显示沉默GYS2的细胞阻滞于S-G2-M期,过表达GYS2导致更多细胞处于G0-G1期(图3D)。此外,克隆形成实验表明GYS2缺失促进HCC细胞增殖,过表达则削弱细胞增殖(图3E)。为了在体内验证这些效应,研究者建立了裸鼠皮下注射细胞的异种移植模型。与对照组相比,GYS2沉默的荷瘤细胞生长更快,糖原含量更少,Ki-67表达更高(图3F)。这些发现表明,缺乏GYS2极大地促进了肝癌细胞的生长。
4. GYS2激活p53信号通路
为了揭示GYS2介导肝癌增殖的潜在机制,研究者在敲除GYS2的HepG2和QGY-7703细胞中进行了RNA seq分析,发现p53通路都受到了明显抑制(图4A);之后在过表达/干扰GYS2的细胞中分别检测了p53及其靶蛋白的含量,发现GYS2过表达促进p53蛋白水平升高,进而调控了p53的靶基因,如p21,14-3-3S和cyclin D1(图4B)。接下来研究者通过Co-IP实验研究了这两个蛋白之间的相互作用(图4C),又通过GST pull-down实验证实了GYS2与p53直接结合(图4D和E),并进一步发现p53的1-101aa区和GYS2的1-500aa区是两者结合所必需的(图4F和G)。为了验证GYS2是否通过p53发挥抗肝癌作用,研究者进行了功能回复实验。恢复p53表达可部分减弱GYS2缺失对HepG2和QGY-7703细胞生长的促进作用。这些数据表明,GYS2在肝癌细胞中通过与p53的相互作用发挥肿瘤抑制作用。
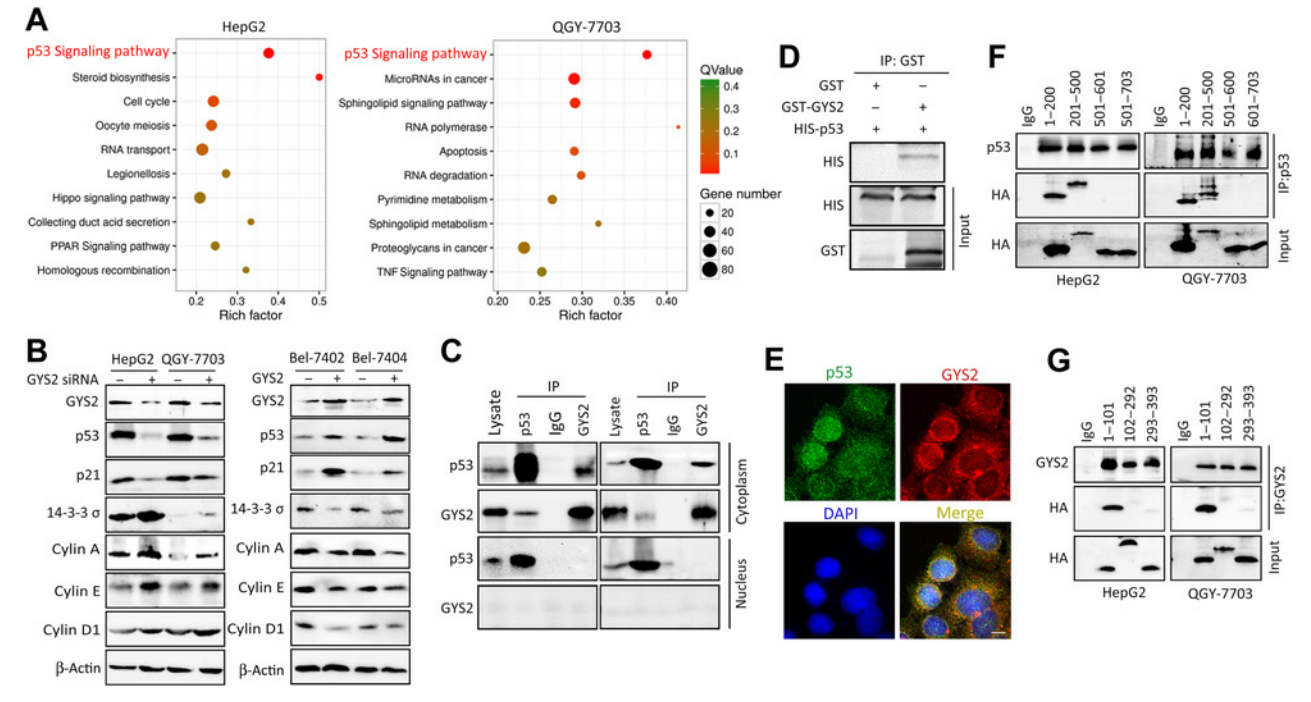
5. GYS2通过与MDM2的竞争性相互作用稳定p53
为探索GYS2上调p53的机制,使用放线菌酮CHX(翻译抑制剂)处理细胞,发现GYS2过表达显著延缓了p53蛋白的降解(图5A)。使用MG-132(蛋白酶体抑制剂)预处理GYS2过表达细胞,p53泛素化的IP-WB结果显示其泛素化水平减弱 (图5B),此外,MG-132的预处理可抵消si-GYS2对p53蛋白水平的抑制 (图5C)。
由于E3泛素连接酶MDM2对p53泛素化起关键调控作用,他们接着探索了MDM2是否参与GYS2对p53的作用。p53泛素化的IP-WB结果表明,GYS2过表达减弱了MDM2过表达引起的p53泛素化增加,而si-GYS2阻断了si-MDM2对p53泛素化的抑制(图5D)。si-MDM2和si-GYS2共处理细胞时,WB结果显示对si-MDM2显著抑制了si-GYS2对p53蛋白的下调 (图5E)。
接下来,研究者通过Co-IP实验发现GYS2、p53和MDM2相互结合形成了蛋白质复合物(图5F)。GST pull-down实验也证实了GYS2与MDM2的直接结合(图5G)。此外,MDM2和p53之间的相互作用因GYS2的下调而增强,因GYS2的过表达而减弱(图5H和I)。这些数据表明,GYS2竞争性结合MDM2来抑制p53泛素化,从而稳定p53蛋白。
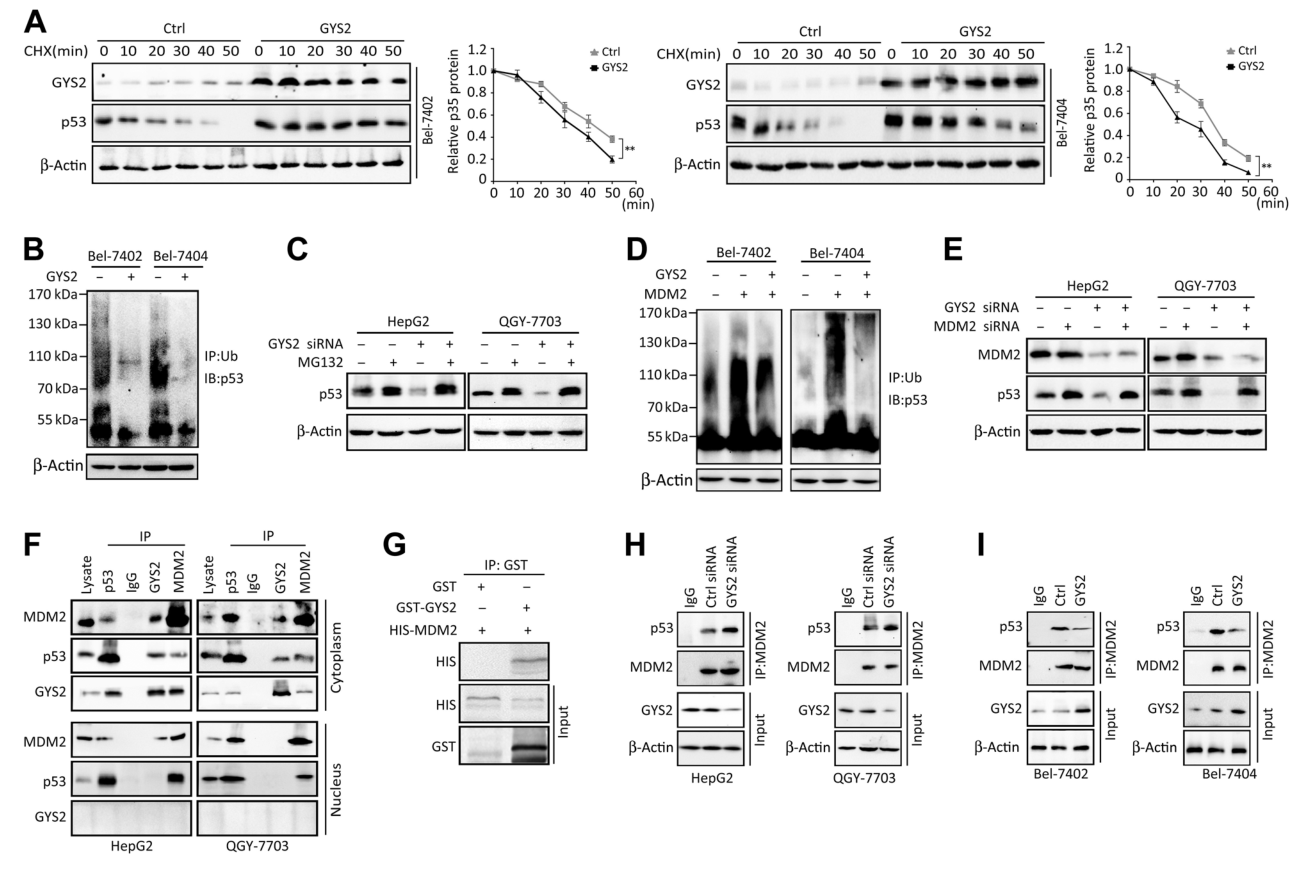
6. P53通过依赖p300的负反馈环抑制GYS2
鉴于GYS2在p53介导的异常糖原代谢中有作用,作者又在p53过表达/干扰情况下检测了GYS2的表达,发现si-p53上调了GYS2的mRNA和蛋白水平(图6B);双荧光素酶报告基因检测发现p53蛋白降低了GYS2启动子的活性(图6C);ChIP实验也证实了p53蛋白与GYS2启动子的结合(图6D)。以上结果表明p53可以负反馈调节GYS2。
p53的转录后修饰是其功能所必需的,例如p300可介导p53蛋白K373/382处的乙酰化,增强其结合靶DNA的能力,因此研究了p300是否影响p53对GYS2的调控。作者发现过表达GYS2增加了p53在K373和 K382位点的乙酰化 (图6E),但当敲除p300后,这一作用消失(图6F)。用特异性p300抑制剂C646或si-p300处理细胞,可以消除p53介导的GYS2水平下降(图6G)。构建不能被p300乙酰化的2个p53突变体(p53-K373A和 p53-K382A)并分别转染细胞,发现GYS2 mRNA和蛋白的减少较少(图6H),此外,在表达p53-K373A或p53-K382A的细胞中,p53对GYS2启动子的抑制作用和结合减弱(图6I和J)。这些结果表明,在负反馈环中,p53通过p300介导的乙酰化在转录水平上抑制GYS2。
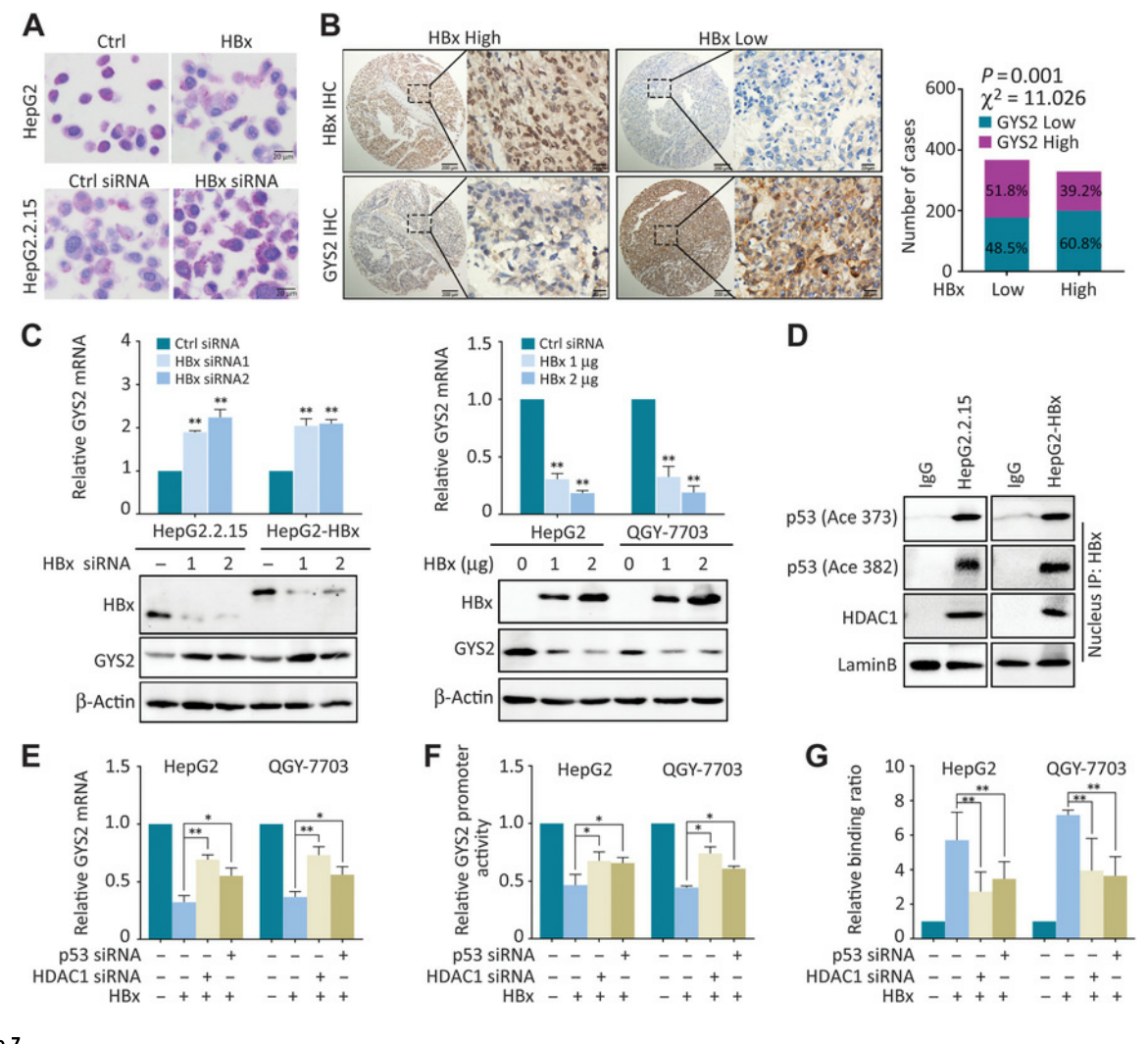
7. HBx-HDAC1复合物促进p53介导的GYS2抑制作用
HBV编码的关键致癌蛋白HBx在糖原代谢中的作用尚不明确。分别在肝癌细胞中过表达或敲除HBx,PAS染色结果显示HBx过表达减少了HCC细胞中的糖原含量,而HBx敲除恢复了这一趋势(图7A)。在HBx阳性的病例中,GYS2的低表达和PAS染色更常见(图7B),而在HBx阴性的肝癌细胞中,过表达HBx下调了GYS2的表达(图7C)。据报道,HBx需要招募协同因子来发挥活性抑制作用,而组蛋白去乙酰化酶(HDAC)是与HBx相互作用的主要基因抑制因子。研究者用HDAC家族蛋白的siRNA处理肝癌细胞,发现只有当HDAC1 被敲除时,GYS2表达上调。Co-IP实验也显示了HBx、HDAC1和细胞核内乙酰化的p53之间的相互作用(图7D)。在HBx过表达的细胞中,HDAC1或p53的敲除部分减弱了GYS2 mRNA的损失 (图7E)。荧光素酶和ChIP实验也表明,HDAC1或p53的敲除降低了HBx与GYS2启动子的结合(图7F和G)。这些数据表明,HBx与HDAC1共同促进了HBV阳性肝癌中p53对GYS2表达的抑制。
结论:
本研究首次报道了HCC组织中糖原含量显著降低,并与不利的患者预后相关,这归因于新鉴定的HBx/GYS2/p53信号轴。GYS2沉默通过靶向p53信号通路促进HCC细胞增殖而非迁移,并提供了两条独立的证据线来支持GYS2和p53之间的关系。一方面,确定p53是GYS2的下游靶点,GYS2在细胞质中与p53相互作用,与MDM2竞争以稳定p53免于蛋白酶体降解;另一方面,p53以负反馈方式抑制GYS2表达和糖原含量。这些数据表明p53和GYS2可能通过平衡彼此的表达而在HCC中发挥功能。









 实验热线:4006991663
实验热线:4006991663












