中文标题:在mir-181a/PPFIA1信号通路中发现致癌的PARP1,或成为BCR-ABL的靶点并有着潜在的治疗作用
发表期刊:Mol Ther Nucleic Acids
影响因子:7.032
发表时间:2019年
合作单位:暨南大学医学院
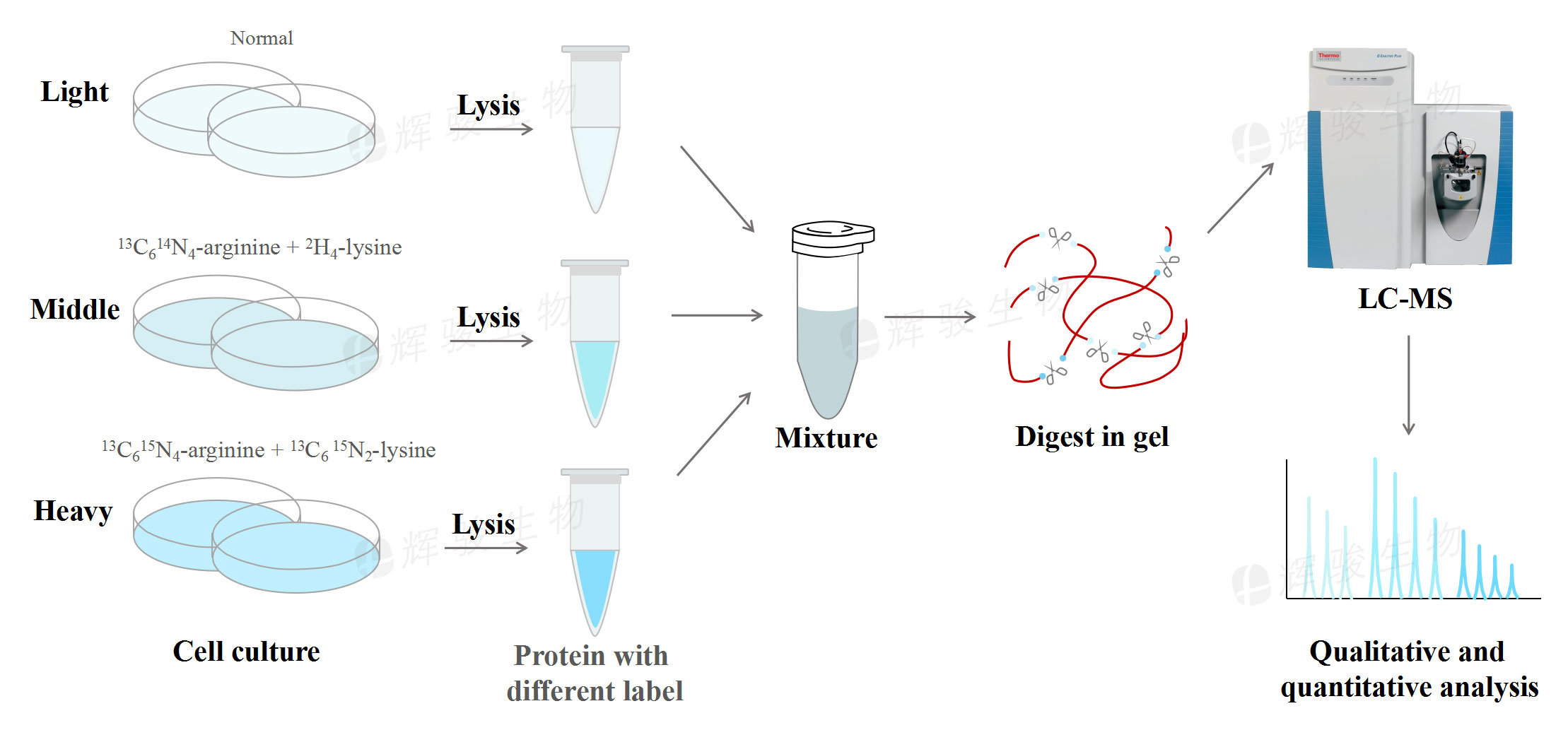
运用技术:SILAC定量蛋白质组学(由辉骏生物提供技术支持)
● 研究背景
慢性粒细胞白血病(CML)是一种克隆性骨髓增生性疾病,每10万人中约有1-2人,占成人白血病总数的15%。MIR-181a在白血病中表达下调,并影响其进展、耐药性和预后,然而,其靶点在白血病,特别是慢性粒细胞白血病(CML)中的确切作用机制尚不清楚。
● 研究路线
1. SILAC结合( LC-MS/MS)分析筛选K562细胞中miR-181a的潜在靶点,选择PPFIA1作进一步分析2. 敲除与过表达实验结合双荧光素酶报告分析表明PPFIA1可能是K562细胞中mR-181a的直接靶点3. 细胞功能实验结果证实PPFIA1和miR-181a的表达水平与K562细胞的恶性表型相关4. 异种移植实验结果表明, PPFIA1 siRNA可能是治疗CML的一种有前途的药物5. 通过磷酸阵列分析检测到 PPFIA1-siRNA降低KIT磷酸化水平6. 过表达与敲除实验表明PPFIA1通过与PARP1相互作用参与了KIT水平的调控,而PARP1调节NF-kB-P65的转录活性
● 研究结果
1. MiR-181a在CM中的直接靶基因PPFIA1
为了确定miR-181a在健康血细胞、人类CML样本和CML细胞系中的表达水平,研究者首先提取了总RNA,并进行了qPCR分析。结果显示,miR181a在人CML样本和CML细胞系中的表达低于其在健康人外周血单个核细胞(PBMC)中的表达(图1A),表明miR-181a的下调可能在白血病发生中起重要作用。接下来,研究者将SILAC-液相色谱-串联质谱(LC-MS/MS)和基因芯片分析相结合,系统地研究了miR-181a过表达对CML细胞株K562的影响(图1C)。SILAC-LC-MS/MS分析表明,重新导入miR181a后,K562细胞中有6000多个蛋白表达下调。然后,用miR-181a模拟物及阴性对照(NC)转染K562细胞后进行基因芯片分析,发现miR-181a模拟转染组有1500多个基因表达下调。为了进一步筛选K562细胞中miR-181a的潜在靶点,研究者结合miRNA预测、SILAC-LCMS/MS和基因芯片方法,确定了15个候选miR-181a靶基因。其中,PPFIA1被选作进一步分析(图1D和1E)。
RT-PCR检测miR-181a是否能下调K562细胞中PPFIA1mRNA的表达,结果显示,转染miR-181a模拟物RNA或PPFIA1小干扰RNA(SiRNA)的K562细胞的PPFIA1mRNA水平明显低于阴性对照组。随后,WB检测miR-181a对PPFIA1蛋白表达的影响,结果显示,MiR-181a和PPFIA1-siRNA的过表达导致PPFIA1蛋白水平降低(图1F)。为了确定PPFIA1的3’UTR是否含有功能性miR-181a靶序列,以及这些序列与miR-181a之间是否发生了直接相互作用,研究者进行了双荧光素酶报告分析。结果如图1G所示,在293T细胞中,miR-181a转染可显著降低psi-Check-PPFIA1-3’UTR的荧光素酶活性,但不能显著降低psi-CHECKPPFIA1-MUT-3’UTR的荧光素酶活性。这些结果表明,PPFIA1可能是K562细胞中miR-181a的直接靶点。
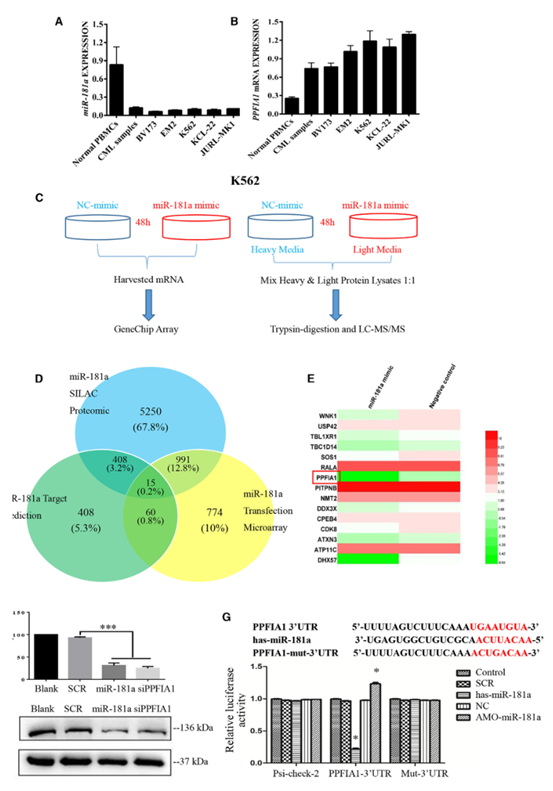
图1
2. PPFIA1或miR-181a在慢性粒细胞白血病恶性进展中的作用
接下来,研究者比较了慢性粒细胞白血病细胞和外周血单个核细胞中PPFIA1mRNA的水平。结果如图1B所示,受试CML细胞和人CML样本中PPFIA1水平较高。接下来,研究者分别在K562细胞中转染PPFIA1
siRNA和miR-181a模拟物,结果显示,MiR-181a转染组和PPFIA1
siRNA转染组均以浓度依赖的方式有效增加K562细胞对IM处理的敏感性(图2A)。Transwell分析还显示,经miR-181a模拟或PPFIA1
siRNA处理后,CML细胞的侵袭能力显著降低(图2B)。最后,转染miR-181a模拟物和PPFIA1
siRNA的K562细胞集落形成能力均明显低于NC组(图2C)。
为了探讨PPFIA1在CML中的高表达是否与疗效有关,研究者用四甲基偶氮唑盐比色法分析了IM作用48h后过表达PPFIA1的K562细胞对IM的敏感性,结果显示过表达PPFIA1明显抑制IM对K562细胞的杀伤作用,表现为细胞存活率增加(图2D)。Transwell细胞侵袭实验结果表明,PPFIA1过表达显著增强了细胞侵袭力(图2E)。克隆形成实验结果也表明,过表达PPFIA1的K562细胞集落数显著高于对照组(图2E)。这些结果表明,PPFIA1和miR-181a的表达水平与K562细胞的恶性表型相关。
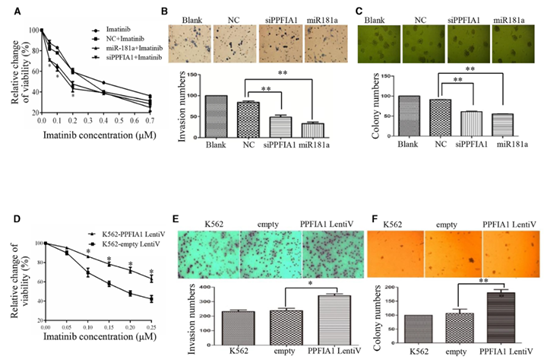
图2
3. PPFIA1 siRNA对CML异种移植小鼠模型的抑制作用
为了探讨PPFIA1-siRNA靶向PPFIA1的治疗潜力,研究者将106个荧光素酶标记的K562细胞注射到NSG小鼠体内,并通过生物成像监测siRNA治疗的效果。结果显示,与NC
siRNA处理组和赋形剂对照组相比,PPFIA1
siRNA显著抑制K562-荧光素酶细胞的生长(图3A);相对荧光素酶水平如图3B所示,在接种肿瘤时,接受NC-siRNA治疗的小鼠的相对荧光素酶水平为1.58e+6,然后在第21天上升到8.01e+8,而在接受PPFIA1
siRNA治疗的小鼠中,其相对荧光素酶水平从1.56e+6上升到1.35e+8。这些结果表明,靶向PPFIA1的PPFIA1-siRNA可以抑制K562-荧光素酶细胞在体内的生长。而体重体重作为动物模型癌症恶病质的重要指标,在肿瘤接种时接受NC-siRNA治疗的小鼠的平均体重为27.9g,在第21天下降到26.4g,而接受PPFIA1-siRNA治疗的小鼠的平均体重从27.9g增加到28.4g(图3C)。接受PPFIA1
siRNA处理的NSG小鼠比使用NC-siRNA和空白对照组的小鼠存活时间更长(图3D)。这些结果表明,PPFIA1
siRNA可能是治疗CML的一种有前途的药物。

图3
4. 通过磷酸阵列分析检测到PPFIA1-siRNA降低KIT磷酸化水平
为了了解PPFIA1增强CML细胞侵袭性和克隆原性的机制,研究者进行了磷酸阵列检测,通过计算两个样品(PPFIA1-siRNA/NC和miR-181a
mimic/NC)在248个位点特异的磷酸化位点上的磷酸化比率确定两者之间的差异(图4A)。在miR-181a模拟转染组中,23个蛋白位点的磷酸化水平降低,其中7个位点与NC转染组相比降低了30%(图4B)。PPFIA1
siRNA转染降低了60个蛋白位点的磷酸化,其中8个位点降低了50%(图4C)。值得注意的是,通过对磷酸化降低比例的比较,研究者发现三种磷酸化靶点,KIT
Tyr721、P38丝裂原活化蛋白激酶(MAPK) Tyr182和血管内皮生长因子受体2 (VEGFR2)
Tyr951位点,它们的磷酸化通常被miR-181a mimic和PPFIA1-siRNA处理降低(图4D)。
KIT与CML发病机制有关,KIT表达BCR-
ABL转导的小鼠髓系细胞对酪氨酸激酶抑制剂不太敏感。因此研究者推测miR-181a的靶点PPFIA1可能通过激活K562细胞的KIT信号通路促进恶性表型。在稳定过表达PPFIA1的K562细胞株中,磷酸化KIT
Tyr721的表达显著增加(图4E),而使用PPFIA1-
siRNA抑制其表达则会产生相反的效果(图4F)。这些数据表明,PPFIA1可能通过激活CML中的KIT通路而发挥致癌作用。
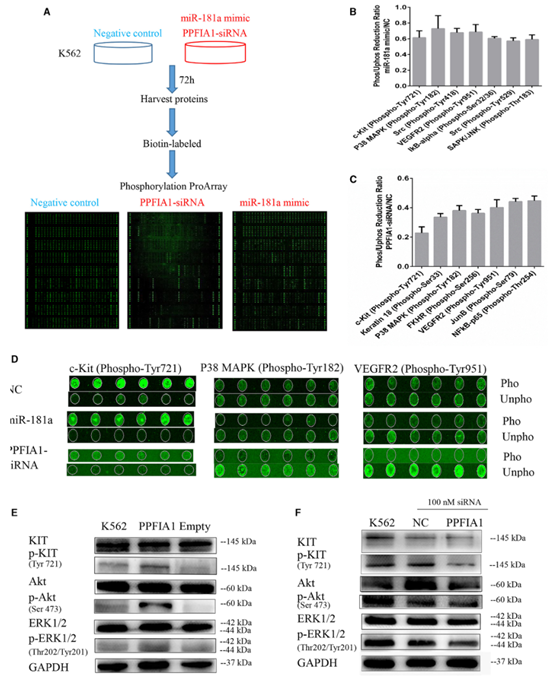
图4
5. PPFIA1和BCR/ABL的重要下游分子PARP1
为了探讨PPFIA1和KIT之间的关系,研究者在K562细胞中异位过表达FLAG-PPFIA1,并进行BCR/
FLAG免疫沉淀(IP)检测。采用SDS-PAGE对BCR和FLAG亲和纯化的IP产物进行分离,并进行质谱分析,结果显示,在K562细胞中,PARP1同时与外源性PPFIA1和内源性BCR相关(图5A)。分子对接分析表明,PARP1催化结构域可以与PPFIA1
(PDB: 3TAC)和ABL1 (PDB: 5HU9)结合(图5B,C)。ABL1的结构域取自PDB (F-actin
PDB),分子对接分析结果显示,ABL1的F-actin结构域可以与PARP1的催化结构域对接(图5D),而SH2结构域不能与PARP1的催化结构域对接。由于无法获得BCR/ABL融合蛋白,研究者纯化了ABL的每个结构域,并进行了SPRi分析,结果证实ABL1的F-actin结构域可以与PARP1结合,与分子对接分析结果一致(图5E)。
有趣的是,除了分子对接分析表明PARP1可以与PPFIA1相互作用外,IP实验也可以识别这种相互作用。如图5F-5I所示,PARP1与PPFIA1和ABL1相互作用,而且可能是PPFIA1或BCR/ABL的重要下游分子。基于这些结果,研究者推测PARP1介导了PPFIA1和KIT过表达之间的关系。
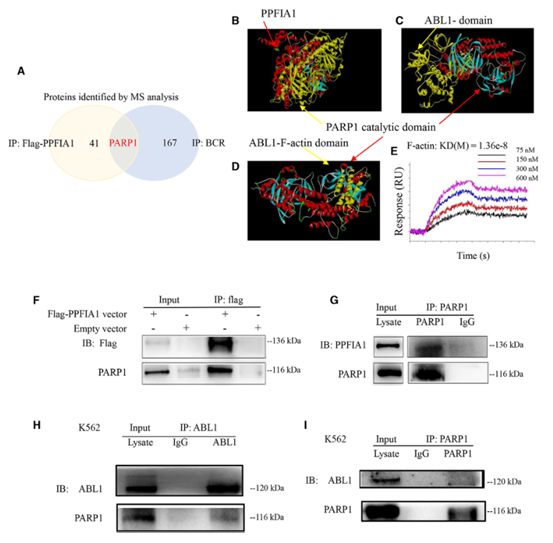
图5
6. PARP1通过激活NF-kB-P65转录促进KIT表达
PARP1在参与DNA修复和转录的几个蛋白上形成分支多聚(ADP)核糖(PAR)聚合物,其中,PARP1是NF-kB转录调节复合物的关键成分。因此,研究者推测PPFIA1通过涉及PARP1、P65和KIT的轴参与白血病的生长。与假设一致,在K562细胞中强制表达PARP1导致P65表达水平上调,而使用奥拉帕尼(PARP1抑制剂[PARPi])降低PARP1表达则导致P65下调(图6A-6C)。此外,在K562细胞中强制表达P65导致KIT
mRNA和蛋白上调,而P65-
siRNA下调P65表达则导致KIT水平下调(图6D-6F)。这些数据表明,PPFIA1通过与PARP1相互作用参与了KIT水平的调控,而PARP1调节NF-kB-P65的转录活性。PPFIA1/PARP1/NF-kB-P65/KIT可能在CML中构成了一个调控轴。
接下来,为了探索靶向PARP1在CML中的治疗潜力,研究者研究了奥拉帕尼对稳定表达PPFIA1的K562细胞的影响。奥拉帕尼显著抑制了表达PPFIA1的慢病毒转化细胞的集落形成能力(图6G)。为了验证奥拉帕尼可能抑制CML在体内的进展这一假设,研究者将Baf3-P210细胞移植到用3Gy
X射线照射的BALB/c小鼠中。移植小鼠每天单独服用奥拉帕利布或卒中生理盐水溶液(赋形剂对照),连续7天。接受奥拉帕利治疗的动物比空载组的动物存活时间更长(图6H)。这些结果表明,PARP是克服慢性粒细胞白血病的一种有前途的治疗方法。
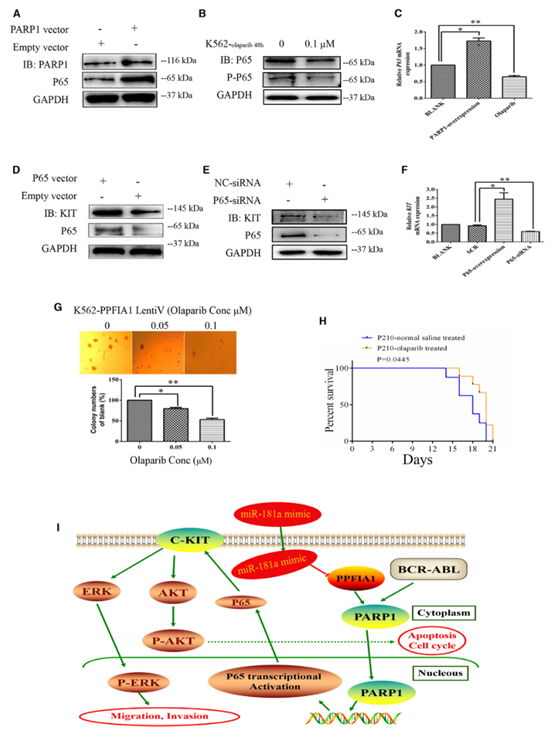
图6








 实验热线:4006991663
实验热线:4006991663